Bull. Math. Biol. 72 (2010) 2180-2198
Nicolas Bacaër
Institut de recherche pour le développement
Les Cordeliers, Paris, France
nicolas.bacaer@ird.fr
Carel Pretorius
SACEMA, DST/NRF Centre d'excellence en analyse et modélisation épidémiologique
Université de Stellenbosch, Afrique du Sud
Bertran Auvert
Assistance Publique - Hôpitaux de Paris, Université de Versailles, INSERM U687, Paris, France
Granich et coll. [Lancet 373 (2009) 48\(-\)57] ont récemment suggéré avec un modèle mathématique simple qu'un test annuel pour le VIH, avec tous les individus séropositifs détectés immédiatement traités avec des antirétroviraux, pouvait conduire au déclin à long terme de l'épidémie en Afrique du Sud. Cela pourrait sauver des millions de vies en quelques années. Le modèle suggérait cependant que ce déclin ne pouvait être atteint avec une moindre fréquence des tests. De nombreux observateurs ont fait remarquer qu'un test annuel était très difficile en pratique. Des essais à petite échelle sont néanmoins en préparation. Dans cet article, on utilise un modèle structuré par âge plus réaliste. Le modèle suggère que les niveaux élevés récemment rapportés d'utilisation de préservatifs pourraient déjà conduire à un déclin à long terme du VIH en Afrique du Sud. Le modèle suggère aussi que des essais qui testeraient par exemple 20% de la population chaque année seraient également intéressants. Ils auraient des avantages similaires, quoique moindres, en terme de réduction de la mortalité et de l'incidence. Ils seraient beaucoup plus facile à généraliser à des populations plus grandes; ils ne conduiraient pas à la persistance à long terme du VIH.
Nos simulations suggèrent enfin que la distribution par âge de l'incidence a changé considérablement au cours des vingt dernières années en Afrique du Sud. Ceci fait douter d'une hypothèse actuellement utilisée par EPP/Spectrum, le logiciel qu'ONUSIDA utilise pour ses estimations.
Il y a actuellement plus de 5 millions de personnes séropositives rien qu'en Afrique du Sud [10,p. 35]. Plus de 300000 personnes y meurent chaque année à cause du SIDA [10, p. 35] malgré le programme d'antirétroviraux, qui fournit un traitement pour les personnes dont la séropositivité a été détectée et dont le nombre de CD4 est inférieur à 200. Les recommendations de traitement en Afrique du Sud vont vraisemblablement hausser ce seuil à 350. Mais il reste le problème que beaucoup de personnes séropositives ignorent leur statut et vont à l'hôpital à un stade très tardif de l'infection, lorsque le nombre de CD4 est déjà bien inférieur à 350 ou à 200.
Un travail de modélisation [14] suggère qu'un test annuel de séropositivité, avec toutes les personnes détectées immédiatement traitées par des antirétroviraux quel que soit le nombre de CD4, pourrait conduire à un déclin à long terme de l'épidémie de VIH. Cela sauverait des millions de vies. Le modèle suggère aussi qu'une moindre fréquence des tests serait insuffisante pour ce déclin mais pourrait tout de même sauver un nombre considérable de vies. La structure et les hypothèses du modèle utilisé dans [14] étaient relativement simples et quelque peu optimistes. Néanmoins les résultats furent suffisamment étonnants pour qu'un certain nombre d'experts commencent à considérer les antirétroviraux non seulement comme un traitement mais aussi comme une méthode possible de prévention, comme les prérvatifs ou la circoncision.
En 2009, l'Organisation Mondiale de la Santé a convoqué plusieurs réunions pour avoir une meilleure compréhension des coûts et des avantages de la stratégie proposée par [14]. Les antirétoviraux (y compris le suivi médical) coûtent annuellement plusieurs centaines de dollars par patient [14]. Même si la nouvelle stratégie « tester et traiter » pouvait sauver des millions de vies, elle coûterait plusieurs milliards de dollars par an pendant au moins une décennie ou deux suite à son déploiement. La modélisation peut aider les agences de financement à décider si un projet aussi coûteux vaut d'être essayé.
Dans cet article, on utilise un modèle structuré en âge pour étudier la stratégie « tester et traiter » de [14]. On considère une communauté hypothétique moyenne dans laquelle la pyramide des âges, la prévalence du VIH et les statistiques de mortalité seraient égales à celles de l'Afrique du Sud au niveau national. Le modèle comporte également une variable pour le temps écoulé depuis l'infection par le VIH et divers paramètres qui prennent en compte l'historique des interventions contre le VIH. Bien sûr, la question de savoir quels détails doivent figurer dans le modèle est sujette à controverse. Il n'y a pas de consensus sur les raisons pour lesquelles l'épidémie s'est propagée si rapidement en Afrique du Sud, quand on la compare avec l'Afrique centrale ou l'Afrique de l'ouest.
D'après [16], l'importante population d'hommes migrants et travaillant dans les mines ainsi que les travailleuses du sexe associées furent un facteur clé. Si tel était le cas, ceci nécéssiterait en principe un modèle différent du nôtre, avec plusieurs groupes à risque. On prendra cependant une prévalence initiale du VIH relativement élevée, en disant que c'est le résultat d'une première épidémie parmi les travailleuses du sexe et leurs clients. D'autres auteurs insistent sur le faible niveau de circoncision parmi les hommes [28] ou le fait que l'âge du premier mariage est relativement tardif [4]. Ces facteurs ne sont pris en compte qu'implicitement à travers les probabilités de transmission du VIH et le taux de rotation par âge des partenaires sexuels.
Il y a déjà eu un grand nombre de modèles structurés par âge pour le VIH, voir par exemple [2, 17, 18, 23]. Notre but est d'essayer de développer le modèle structuré par âge le plus simple qui puisse s'ajuster aux données par âge de la prévalence du VIH et de la mortalité en Afrique du Sud, y compris à l'enquête dans la population de 2008 [21]. Le résultat est donc d'une complexité intermédiaire: avec des antirétroviraux contrairement aux premiers modèles [2], mais sans les groupes à risque de [17] et sans les paires en couple de [18], avec des hypothèses mécanistes pour l'incidence contrairement à [23]. L'un des principaux défis pour notre modèle est de reproduire la croissance rapide de l'épidémie au début des années 1990 et la stabilisation récente au niveau observé en Afrique du Sud.
La section 2 décrit les paramètres de notre modèle. Les équations sont données dans l'appendice. La section 3 montre comment notre modèle s'ajuste aux données historiques. Elle montre aussi des projections pour les dix prochaines années selon trois scénarios: continuation du programme actuel d'antirétroviraux, une stratégie modérée « tester et traiter » avec 20% de la population testée chaque année, et une stratégie intensive « tester et traiter » presque comme dans [14] mais avec 50% de la population testée chaque année. Les résultats suggèrent que, si le haut niveau d'utilisation de préservatifs rapporté récemment n'est pas trop éloigné de la réalité et continue, alors tous les scénarios conduisent au déclin à long terme du VIH. Mais comme on le montre dans la section 4, une stratégie additionelle « tester et traiter » peut sauver un nombre considérable de vies dans la prochaine décennie, ce nombre croissant avec la fréquence des tests. Donc un test annuel, comme requis par [14], n'est peut-être pas si critique pour le succès des futurs essais.
Notre modèle suggère aussi que la distribution par âge de l'incidence a varié considérablement au cours des dix dernières années en Afrique du Sud, probablement parce que l'utilisation de préservatifs a augmenté beaucoup plus vite chez les jeunes adultes que chez les autres groupes. Ceci fait douter de la méthode utilisée par le logiciel EPP/Spectrum pour calculer l'incidence par âge du VIH. EPP/Spectrum est un logiciel utilisé par ONUSIDA pour ses estimations.
Les équations de notre modèle et un résumé des valeurs des paramètres se trouvent dans l'appendice. Notre programme informatique est disponible sur www.ummisco.ird.fr/perso/bacaer/SAHIV.sci et tourne avec Scilab (http://www.scilab.org), un logiciel libre très semblable à MatLab.
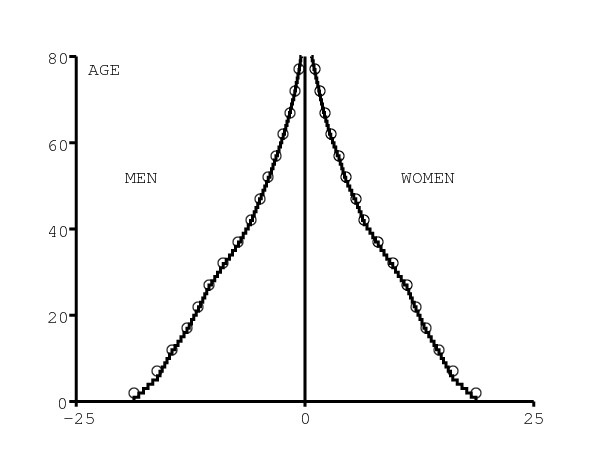
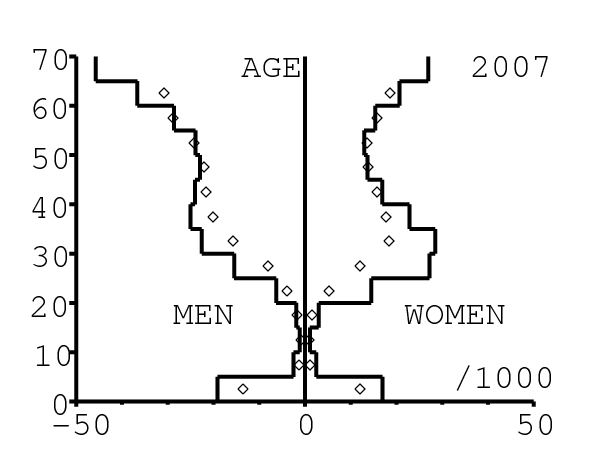
Le modèle comprend les personnes d'âge entre 0 et 100 ans. Les simulations commencent en 1986 (voir section 2.4 ci-dessous pour une explication de ce choix). On imagine une communauté qui a la même structure par âge que l'Afrique du Sud toute entière. On utilise pour cela la base de données internationale du Bureau de recensement américain [26] (figure 1a). Puisque [26] donne la population par groupes de 5 années d'âge, on a distribué les âges dans chaque groupe pour obtenir une pyramide des âges lisse. La pyramide des âges est remise à l'échelle pour avoir 20 naissances masculines et 20 naissances féminines en 1986. La communauté contient donc environ 1400 personnes.
Puisque la simulation démarre avec une personne infectée en 1986 (voir la section 2.4), cela signifie que la prévalence initiale du VIH parmi les adultes est environ 1/1000. Si le temps de doublement est d'un an, la prévalence du VIH peut atteindre un pourcent en quatre ans. Si l'on considérait une communauté plus grande, disons 100 000 personnes, avec seulement une personne infectée au départ, il faudrait dix années pour que la prévalence atteigne le même niveau. Mais la prévalence était très faible en 1986 et déjà relativement élevée en 1991 (voir la section 3). Autrement dit, on imagine que l'épidémie a eu deux phases:


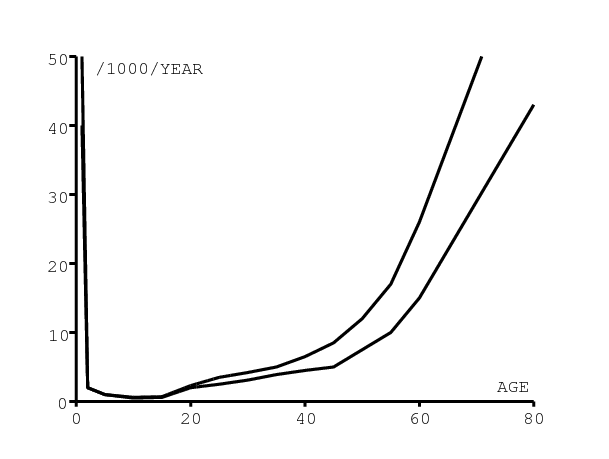
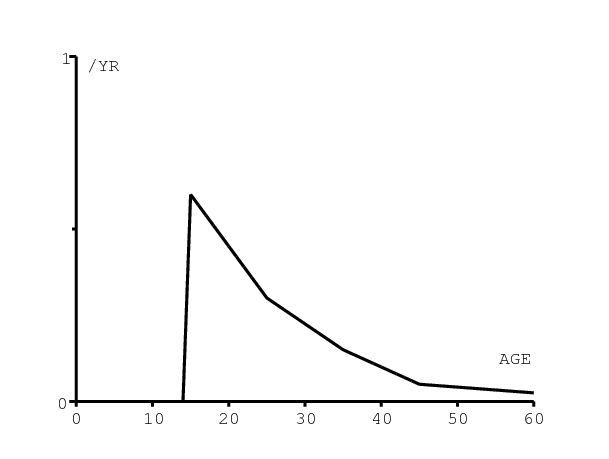
On utilise les courbes typiques [1, p. 6] pour la mortalité des personnes séronégatives âgées de plus de 15 ans. D'après [25], on a pour les enfants qui sont nés en 1990
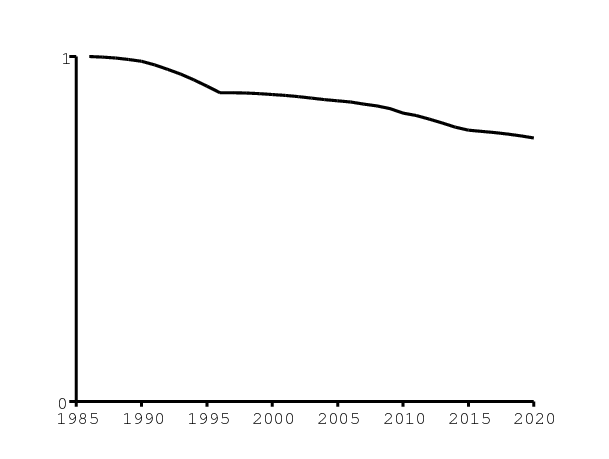
Il y a eu une transition démographique en Afrique du Sud au cours des deux dernières décennies. Comme ceci est difficile à modéliser, on prend simplement le nombre annuel de naissances rapporté depuis 1986 et extrapolé jusqu'en 2020 par [26]. Plus précisément, on tient compte de la réduction proportionnelle du nombre de naissances, en comparaison avec 1986 (figure 2a).
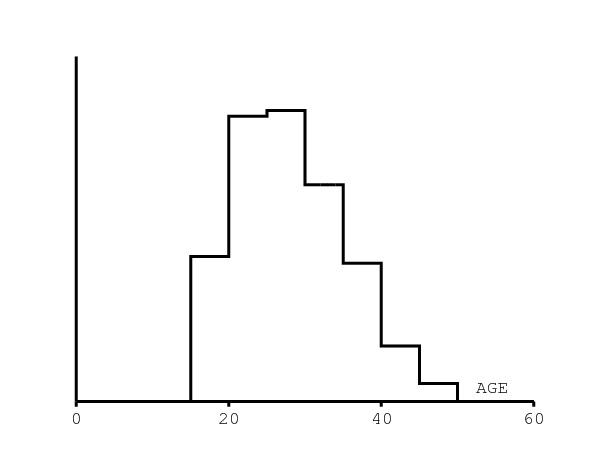
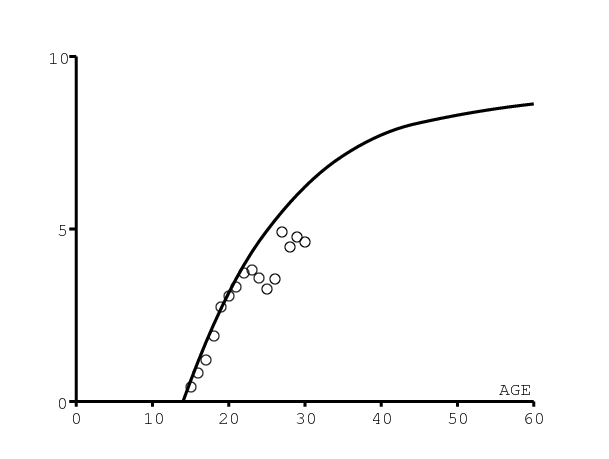
Bien que le processus de naissance ne soit pas modélisé d'une manière mécaniste, on a tout de même besoin de la fertilité féminine par âge normalisée pour estimer la transmission du VIH de la mère à l'enfant. La courbe en groupes d'âge de 5 ans est prise de [25] et montrée dans la figure 2b. On suppose pour simplifier que la fertilité est uniforme au sein de chaque groupe d'âge.
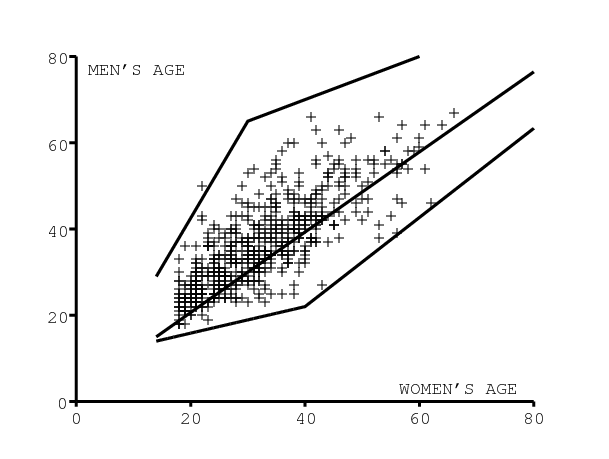
Supposons que le taux de rotation des partenaires sexuels masculins soit donné en fonction de l'âge de la femme par la figure 3a. Alors on obtient un ajustement relativement bon au nombre cumulé de partenaires sexuels masculins tel qu'il a été mesuré dans une étude sur des femmes de 15 à 30 ans à Orange Farm, un bidonville près de Johannesbourg (figure 3b, communication personnelle de \(\,\text{Bertran Auvert}\)). La croissance rapide de l'épidémie de VIH en Afrique du Sud est cependant difficile à reproduire en simulation avec notre modèle si l'on ne tient pas compte d'une sous-déclaration importante du nombre de partenaires sexuels. On utilisera donc un facteur correctif, comme cela est expliqué dans la section 2.5 ci-dessous.
 |
 |
On suppose que la fonction qui décrit comment les femmes d'âge x choisissent des partenaires sexuels masculins d'âge y est une distribution de probabilité triangulaire,
 |
 |
Les enquêtes nationales de 2002, 2005 et 2008 contiennent des statistiques concernant l'usage d'un préservatif lors du dernier rapport sexuel [21, p. 45]. Le pourcentage d'utilisation d'un préservatif, tel que les femmes le rapportent, et son intervalle de confiance se trouvent dans la figure 5a et la figure 5b pour les groupes d'âges 15-24 (cercles blancs), 25-49 (losanges noirs) et plus de 50 ans (losanges blancs). Les données pour les groupes d'âge 15-24 et 25-49 pour l'année 1998 sont une moyenne des données d'une enquête démographique et sanitaire [6, p. 89]. Noter que l'on ne tient pas compte des statistiques d'utilisation des préservatifs rapportées par les hommes [21, p. 45], qui sont significativement plus élevées dans le groupe d'âge 15-24. Il peut néanmoins y avoir un biais statistique à la fois chez les hommes et les femmes.
Pour notre modèle, on suppose pour simplifier que l'utilisation est une fonction de l'âge de la femme mais pas de l'âge de l'homme. C'est une fonction linéairement décroissante de l'âge, après le premier rapport sexuel à 14 ans, comme le suggèrent les données [21, p. 45]. On suppose que l'utilisation maximale de préservatifs croît linéairement de 0 à 10% entre 1987 et 1995, de 10% à 80% entre 1995 et 2007, et reste constant après. On suppose que l'utilisation de préservatifs décroît exponentiellement avec l'âge. On suppose que le taux auquel elle décroît avec l'âge décroît lui-même avec le temps pour obtenir une meilleur ajustement aux données. Voir les détails en appendice.
L'utilisation de préservatifs pourrait encore croître dans tous les groupes d'âge. On fait néanmoins l'hypothèse prudente qu'elle restera au niveau rapporté en 2008, qui était déjà élevé. La figure 5a montre le niveau d'utilisation des préservatifs dans le modèle aux âges 20, 35 et 60 (representant d'une certaine manière les groupes d'âge 15-24, 25-49 et plus de 50 ans) en fonction du temps (lignes continues).
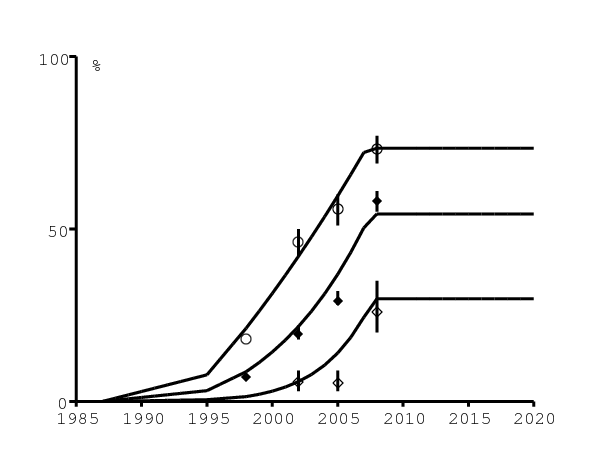
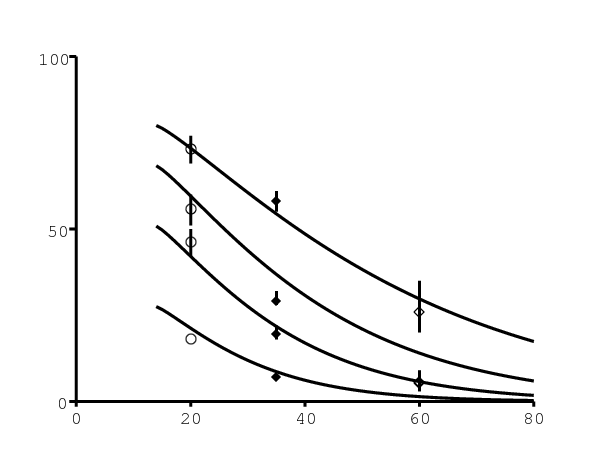
La figure 5b montre les mêmes niveaux d'utilisation de préservatifs mais en fonction de l'âge pour les années 1998, 2002, 2005 et 2008. Comme pour le nombre de partenaires sexuels, il y a probablement un biais statistique dans le niveau rapporté d'utilisation de préservatifs, un biais vers la sur-déclaration. Pour simplifier, on n'ajuste que le biais pour le nombre de partenaires sexuels.
On suppose que la mortalité due au SIDA des personnes séropositives sans antirétroviraux dépend du temps écoulé depuis l'infection mais pas de l'âge pour les adultes et les enfants de plus de 5 ans. Plus exactement, on suppose que cela correspond à une courbe de survie de Weibull avec un paramètre de forme égal à 2,25 comme dans [14]. On prend cependant une durée de vie médiane de 10 ans au lieu de 11 ans, car cela donne un meilleur ajustement dans la figure 8a. La figure 6a montre la courbe de survie combinant à la fois la mortalité naturelle et la mortalité due au SIDA pour une femme infectée à 20 ans. Pour les enfants séropositifs de moins de 5 ans, il y a une surmortalité supplémentaire de 30% durant la première année de vie. On suppose que la surmortalité retourne linéairement au même niveau que celui des adultes après 5 ans. Cette hypothèse s'ajuste assez bien avec les données de [13]. La figure 6a montre ainsi la courbe de survie d'une fille infectée à la naissance.
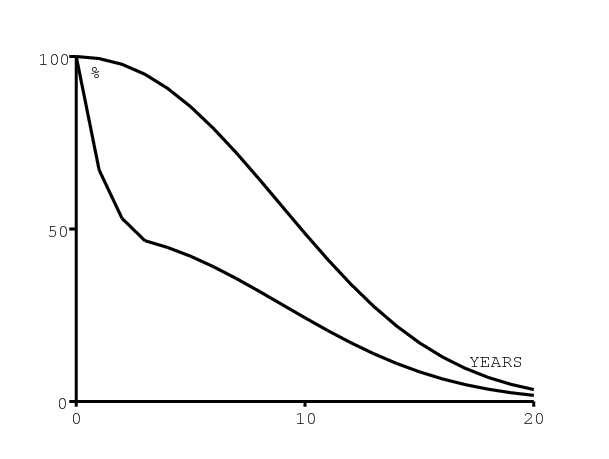
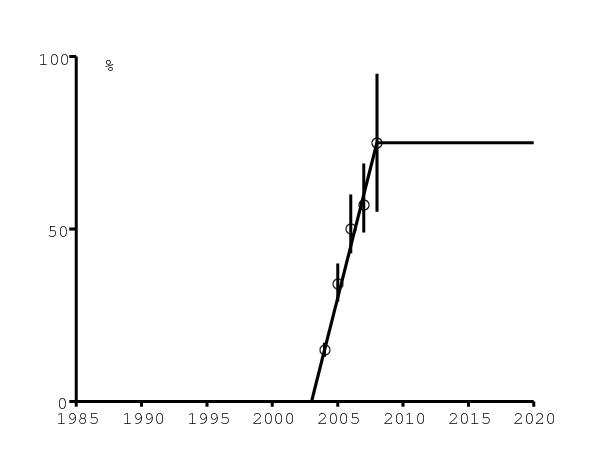
En Afrique du Sud, la névirapine est disponible dans les hôpitaux publics depuis 2002. On suppose qu'elle réduit la probabilité de transmission du VIH de la mère à l'enfant de 40% à 5% (voir [23] pour une discussion plus détaillée) et que l'accès à la prévention de la transmission de la mère à l'enfant a augmenté de 0 à 75% entre 2003 et 2008, restant constante par la suite (figure 6b). Les données et les intervalles de confiance dans la figure 6b pour les années 2004-2008 proviennent de [24, p. 278] et [27, p. 101].
On suppose que l'accès au programme actuel d'antirétroviraux a augmenté de 0 à 100% entre 2003 et 2007 (figure 7a ci-dessous, ligne en pointillé). On suppose que dans ce programme, seulement 40% des personnes séropositives finissent par recevoir des antirétroviraux, indépendemment de l'âge et du temps écoulé depuis l'infection. Ce pourcentage a été choisi pour s'ajuster au nombre total de personnes recevant des antirétroviraux (voir la figure 8b ci-dessous). Si l'on avait des données séparées pour le nombre d'hommes et de femmes recevant des antirétroviraux, le nombre de femmes étant sûrement supérieur car les femmes peuvent recevoir des antirétroviraux suite à une visite pour grossesse, on pourrait utiliser des pourcentages différents. Aucun changement très significatif du pourcentage de personnes séropositives qui finissent par recevoir des antirétroviraux ne devrait résulter d'un changement du seuil de CD4 de 200 à 350, vu que le nombre moyen de CD4 au début des traitements est déjà bien inférieur à 200; ce n'est que quand les personnes séropositives commencent à se sentir très malades qu'elles vont à l'hôpital, se font tester et reçoivent éventuellement un traitement.
On suppose comme dans [14] que les personnes qui reçoivent des antirétroviraux sont 100 fois moins infectieuses que les personnes séropositives qui n'en reçoivent pas, même si cela est peut-être un peu optimiste.
On suppose enfin que les individus qui reçoivent des antirétroviraux ont une mortalié constante liée au SIDA égale à la moitié de la mortalité juste avant de démarrer le traitement. Par exemple, quelqu'un qui démarre les antirétroviraux après 10 ans d'infection voit sa surmortalité due au SIDA baisser de 13,6% par année à 6,8% par année, survivant ainsi en moyenne 15 ans. Quelqu'un qui démarre les antirétroviraux après 15 ans d'infection voit sa surmortalité due au SIDA baisser de 22% par année à 11% par année, survivant ainsi en moyenne 9 ans. Il est difficile de traduire ces hypothèses en terme de nombre de CD4 vue la variabilité de ce nombre parmi les personnes séronégatives [14, supplément, figure 1]. On suppose comme dans [14] que 1,5% des personnes arrêtent le traitement chaque année.
On suppose que la première personne infectée arrive dans notre modèle en 1986. Une grande enquête faite en 1986 a montré qu'il n'y avait quasiment pas de VIH en Afrique du Sud à cette époque [12]. On suppose quelque peu arbitrairement que la première personnes infectée est une femme âgée de 16 ans. Noter cependant que commencer avec une femme plus âgée, et donc avec un taux de rotation des partenaires sexuels masculins plus faible, décale la courbe épidémique de quelques années. Bien sûr, le premier cas pourrait aussi être un homme.
Il y a deux caractéristiques de l'épidémie en Afrique du Sud qu'un modèle doit reproduire: la croissance très rapide au début et la stabilisation à un niveau de prévalence élevé en l'espace d'une dizaine d'années. Dans le modèle sans structure d'âge de [14], ceci a été obtenu avec une grande reproductivité initiale et en supposant que l'incidence décroît exponentiellement avec la prévalence à cause des changements de comportement. Ceci veut aussi dire que l'incidence tend à croître quand la prévalence décroît à cause des interventions. Le modèle a produit une courbe d'allure logistique et il était donc suffisant de régler deux ou trois paramètres pour l'ajuster aux données du VIH. [3] a utilisé la même méthode.
Dans notre modèle plus mécaniste, des simulations ont suggéré qu'il était difficile de reproduire la croissance rapide du début de l'épidémie avec un taux de rotation des partenaires sexuels tel que dans la figure 3a. La force d'infection fait intervenir le produit de ce taux avec une probabilité de transmission par couple (en général différente de l'homme à la femme et de la femme à l'homme).
Même en choisissant des valeurs élevées de la probabilité de transmission par couple (85% de l'homme à la femme et 50% de la femme à l'homme), on a dû supposer que le véritable nombre cumulé de partenaires sexuels masculins était le double de celui rapporté dans la figure 3b. Ceci conduit à un nombre cumulé de partenaires sexuels masculins qui tend vers 16 au lieu de 8 sur toute la vie. On obtient ainsi un bon ajustement avec les prévalences par âge du VIH en 2002, 2005 et 2008 [21].
On a essayé trois scenarios à partir de 2010:
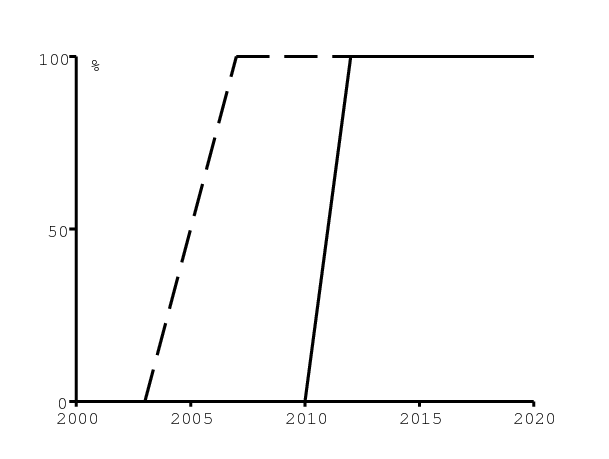
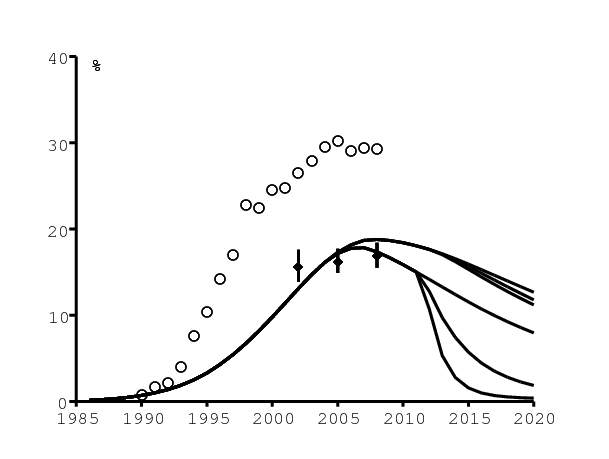
Focalisons-nous d'abord sur les statistiques agrégées. La figure 7b montre (de haut en bas) la prévalence du VIH dans les cliniques prénatales, la prévalence du VIH dans la population âgée de 15 à 49 ans, et la prévalence des personnes séropositives sans antirétroviraux dans la population âgée de 15 à 49 ans. Les données des cliniques prénatales (cercles blancs) pour les années 1990-2008 viennent de [10, p. 7]. Les points noirs pour la population âgée de 15 à 49 ans viennent de [21, p. 31]. Les lignes continues du haut dans la figure 7b (les trois scénarios sont difficiles à distinguer) sont issues de notre modèle et montrent la prévalence dans la population âgée de 15 à 49 ans.
Les deux stratégies « tester et traiter » ont peu d'effet sur la prévalence totale du VIH puisque la décroissance du nombre de nouvelles infections est compensé par la décroissance de la mortalité due au SIDA. Les trois lignes continues du bas dans la figure 7b représentent la population séropositive sans antirétroviraux. La courbe la plus en bas correspond à la stratégie avec la fréquence des tests la plus grande. Contrairement à [14, figure 4B], la prévalence du VIH décline (et convergerait asymptotiquement vers zéro) même dans le scénario de base sans stratégie « tester et traiter ». Bien sûr, cela ne veut pas dire qu'il n'y a pas besoin d'intervention nouvelle.
La figure 8a montre la mortalité, à savoir le nombre total de décès divisé par la population totale. Les losanges blancs correspondent aux décès enregistrés [22], les cercles blancs aux décès estimés par [1], et les losanges noirs aux décès estimés par [26]. Le nombre de décès enregistrés le plus récent (losange blanc, année 2007) sera probablement révisé l'année prochaine car il y a un délai dans le traitement des registres de décès. Notre modèle ne tient pas compte de la décroissance continue de la mortalité hors SIDA, qui était responsable de la petite baisse de la mortalité au début des années 1990 selon [26] (cette baisse était plus évidente durant les années 1980, données non représentées). Évidemment, la stratégie « tester et traiter » avec la fréquence des tests la plus élevée réduit le plus la mortalité.
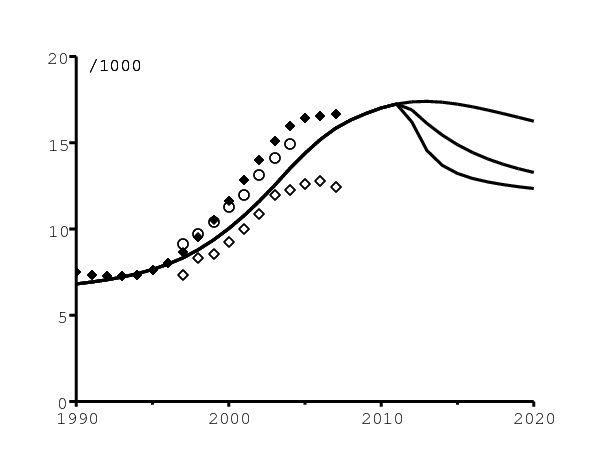
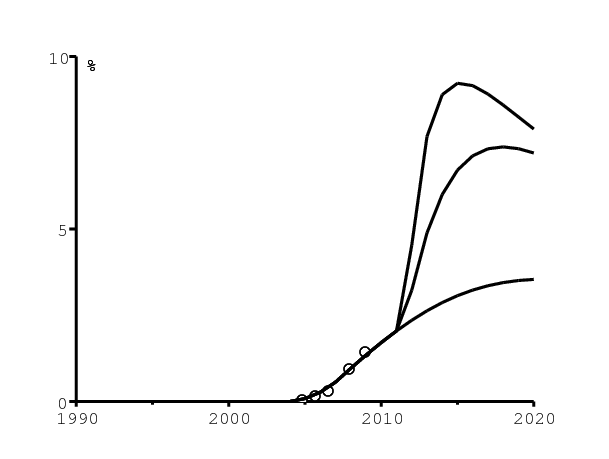
La figure 8b montre comment le modèle s'ajuste aux données concernant la proportion de la population totale qui reçoit des antirétroviraux. Comme le rapporte [11, p. 16], il y avait 19 500 personnes recevant des antirétroviraux du secteur de santé public en octobre 2004, 78 000 en juillet 2005, et 140 000 en mars 2006. D'après [27, p. 56], le nombre de personnes recevant des antirétroviraux a atteint 458951 en décembre 2007 et 700500 en décembre 2008. Les proportions correspondantes de la population totale ont été obtenues en divisant ces nombres par la population totale de l'Afrique du Sud estimée dans [26]. Le nombre de personnes sous antirétroviraux commencerait déjà à décroître après 2015 dans la stratégie « tester et traiter » la plus intensive.
La figure 9a montre l'incidence du VIH parmi les adultes (âge ≥15) selon les trois scénarios. Le changement soudain de la pente de la courbe en 2008 est dû à la croissance de l'utilisation des préservatifs avant 2008 et à notre hypothèse selon laquelle l'utilisation des préservatifs reste constante après 2008 (figure 5). Le cercle (resp. le point noir) dans la figure 9a représente l'estimation pour 2008 d'ONUSIDA (resp. d'ASSA, la Société des actuaires d'Afrique du Sud) pour l'incidence chez les adultes [10, p. 35]. D'après notre modèle, l'incidence avec le programme actuel d'antirétroviraux serait encore au-dessus de 0,5\(\%\) par an en 2020.
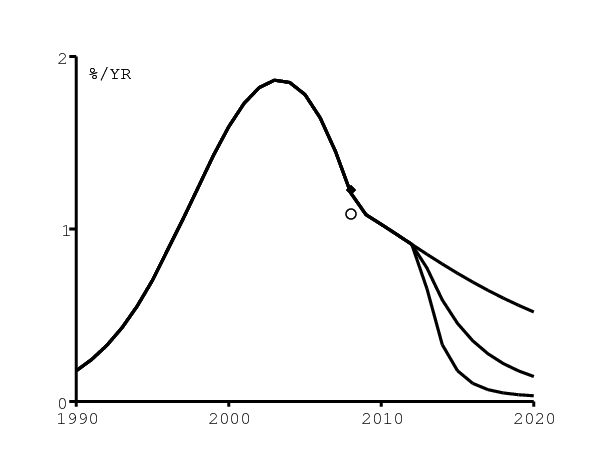
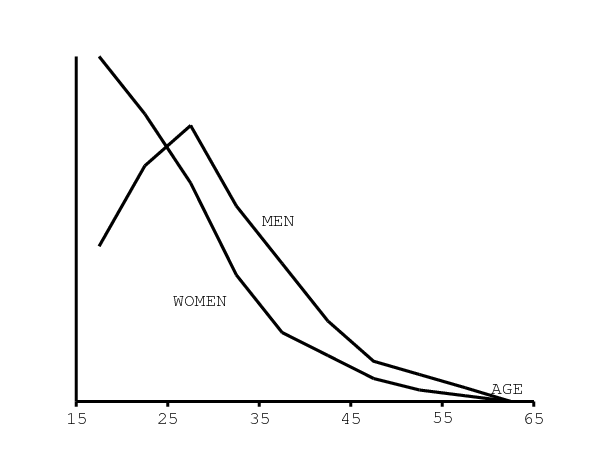
Après ces statistiques agrégées, regardons celles structurées par âge. Rappelons tout d'abord que Spectrum, le logiciel utilisé par ONUSIDA pour ses estimations, suppose que la distribution par âge normalisée de l'incidence du VIH chez les hommes et les femmes est constante au cours du temps (figure 9b); la variation temporelle de l'incidence totale y est donnée par un autre logiciel, EPP [23, p. 16].
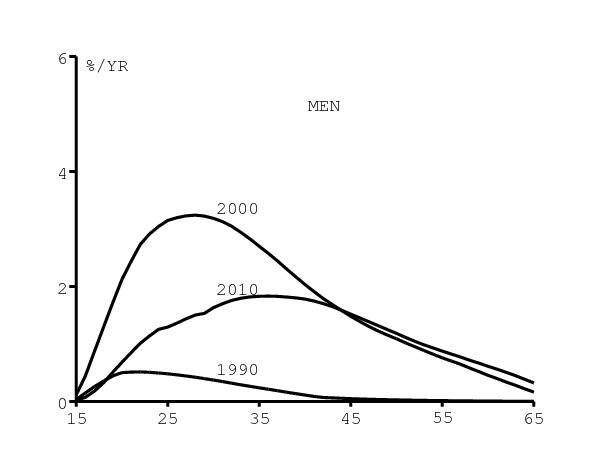
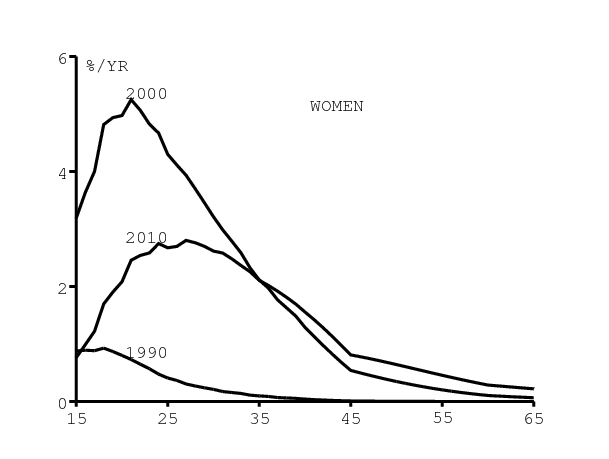
La figure 10 montre par contraste comment la distribution par âge de l'incidence du VIH change au cours du temps dans notre modèle. Il y a un changement assez significatif. Que ce soit pour les hommes (figure 10a) ou pour les femmes (figure 10b), l'âge auquel l'incidence est maximale se décale vers les âges croissants entre 1990 et 2010. C'est dû à l'utilisation croissante des préservatifs. Cette croissance a été plus rapide chez les jeunes adultes que chez les personnes plus âgées, d'après la figure 5.
Noter que la distribution pour les hommes utilisée dans Spectrum (figure 9b) est proche de celle que l'on obtient pour l'an 2000, l'incidence maximale étant atteinte entre 25 et 30 ans. Mais notre simulation suggère que le pic est atteint vers 35 ans en 2010 (figure 10a). De même, la distribution utilisée par Spectrum pour les femmes (figure 9b) est proche de celle que l'on obtient pour l'année 1990, avec une incidence qui décroît en fonction de l'âge. Mais on obtient des distributions assez différentes pour les années 2000 et 2010.
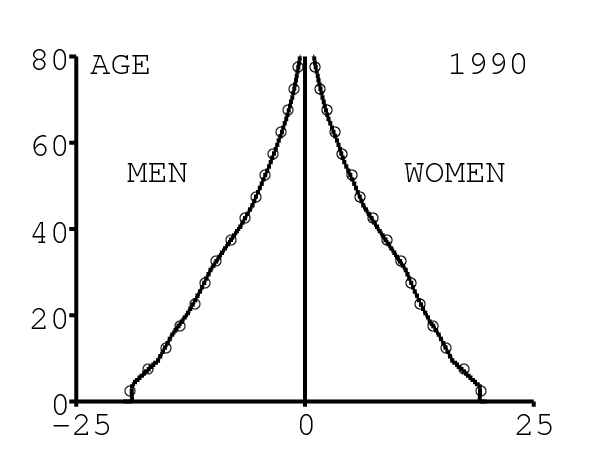
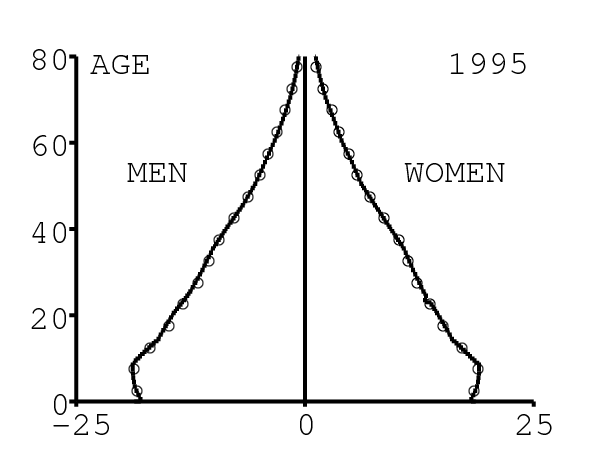
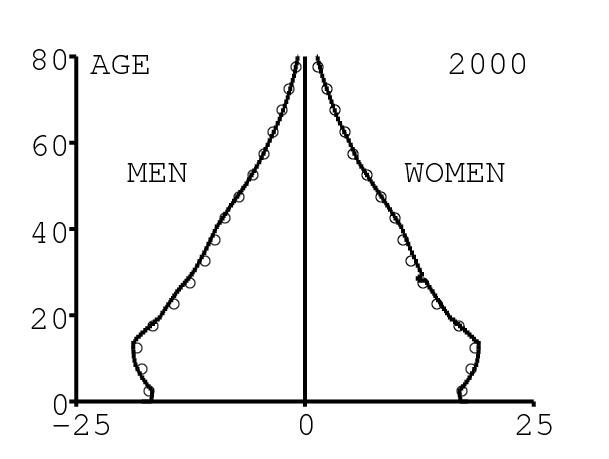
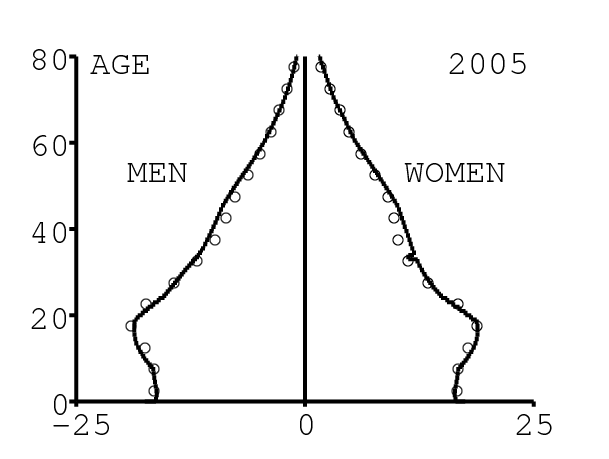
La figure 11 montre la pyramide des âges produite par le modèle. On compare la pyramide tous les 5 ans avec celle donnée par [26] (cercles blancs), pour vérifier. Il est important d'avoir une structure par âge correcte pour pouvoir ajuster à la fois les données agrégées et les données désagrégées par âge.
 |
 |
 |
 |
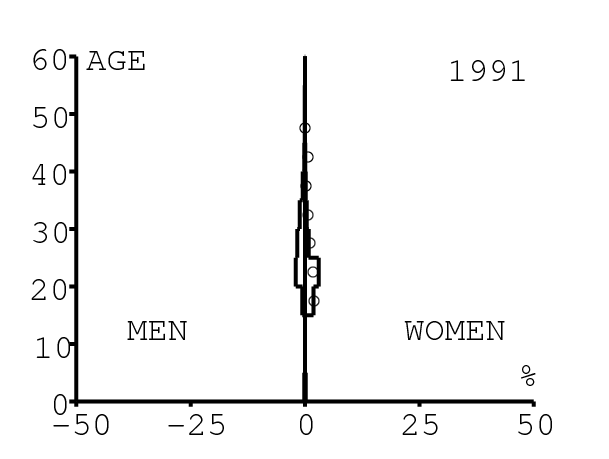
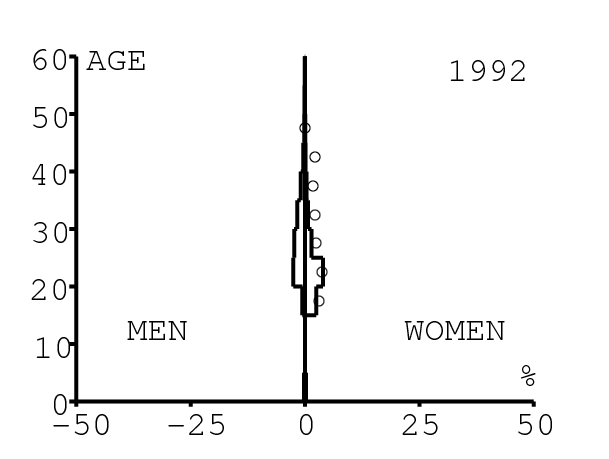
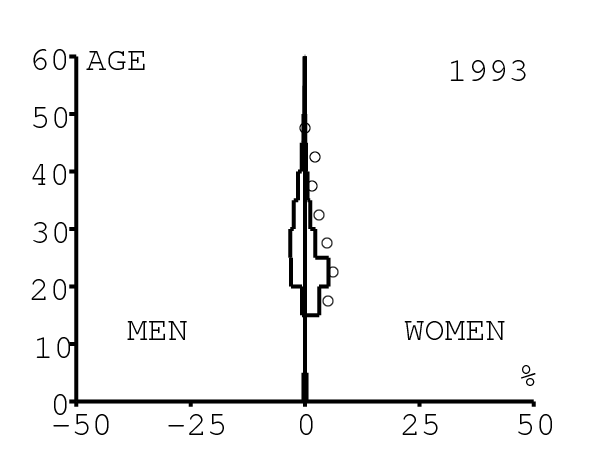
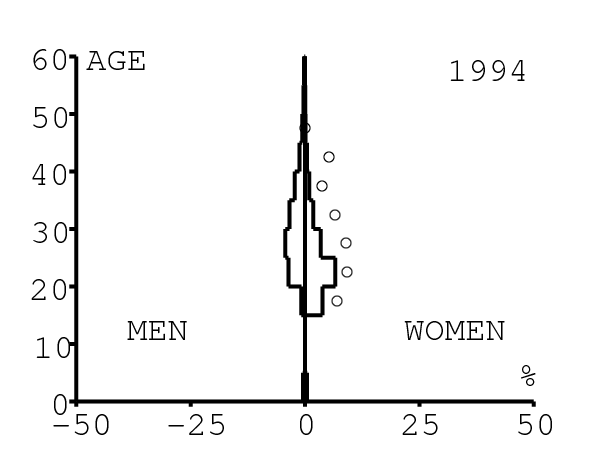
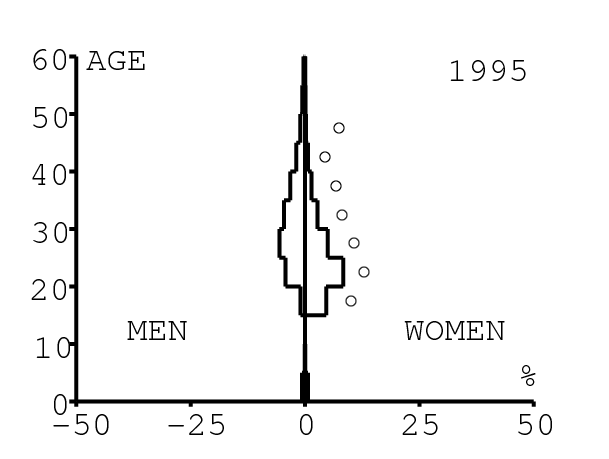
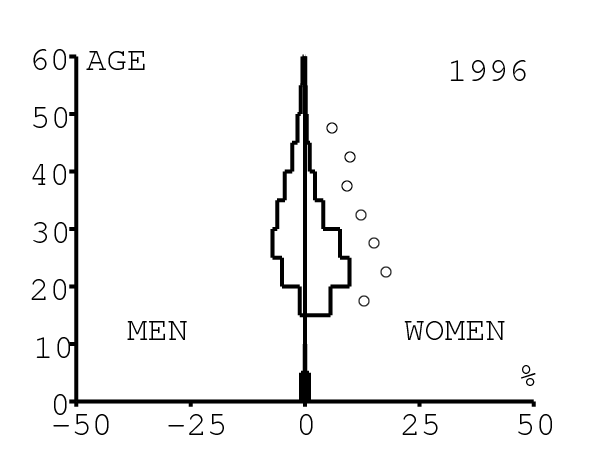
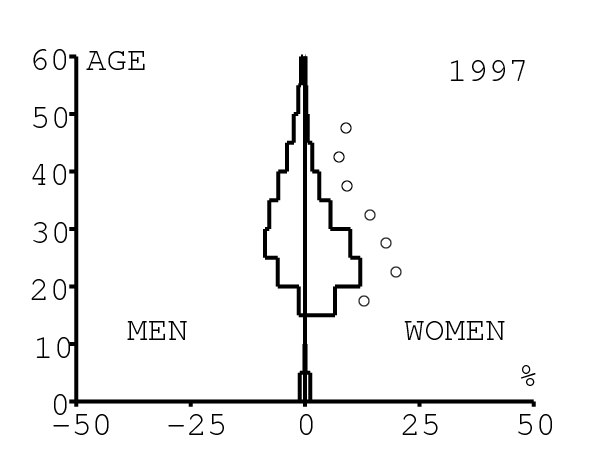
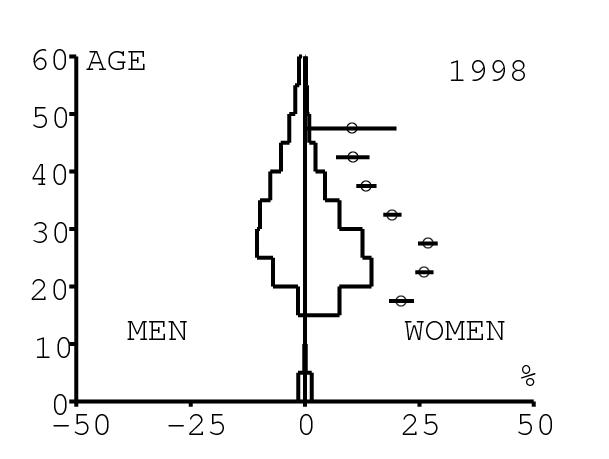
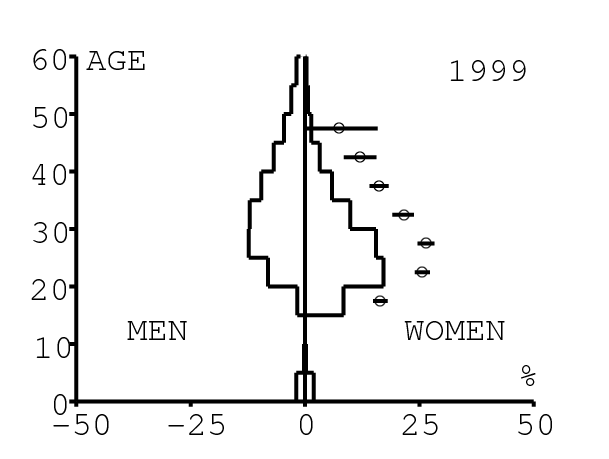
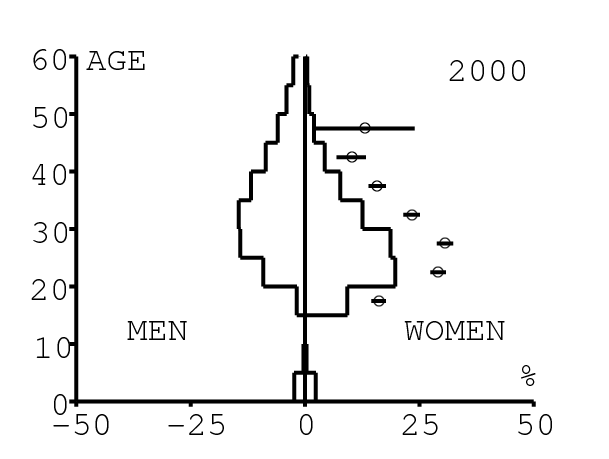
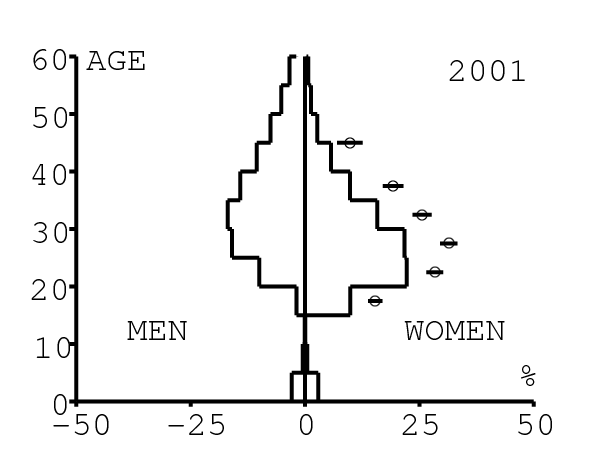
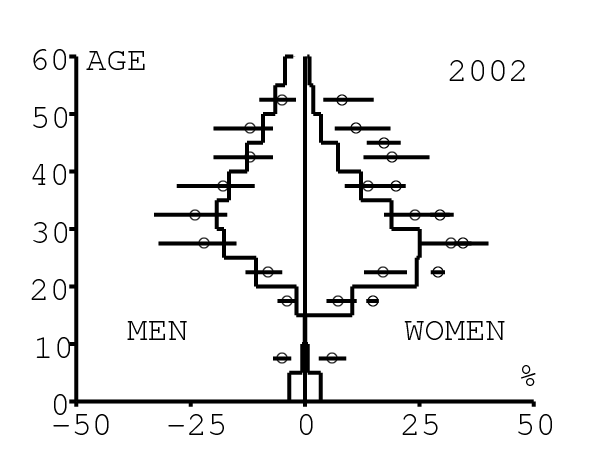
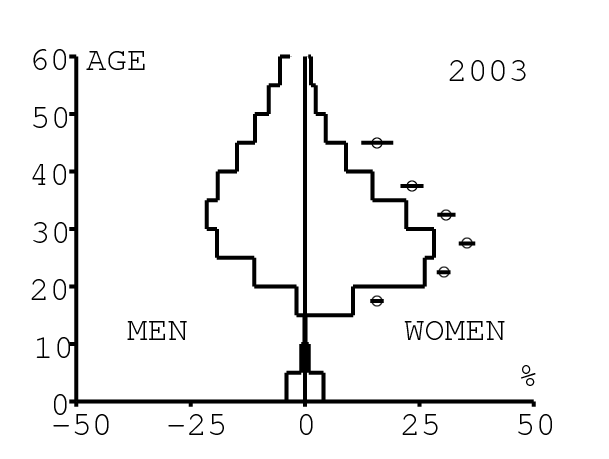
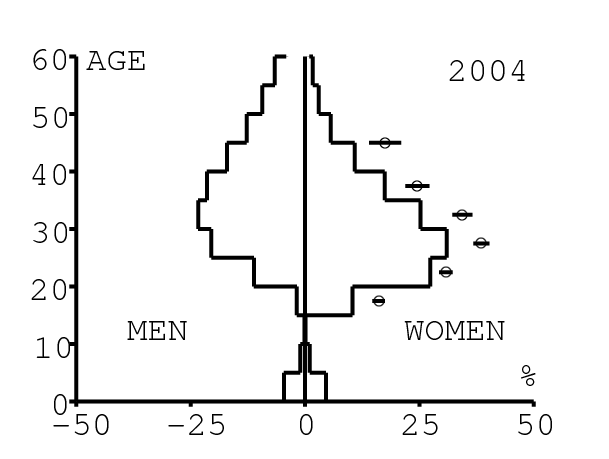
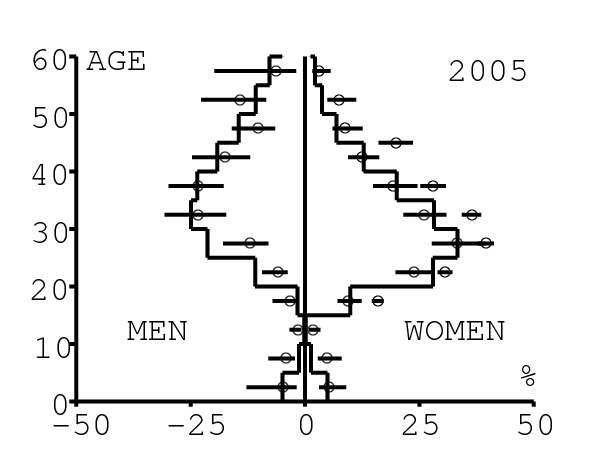
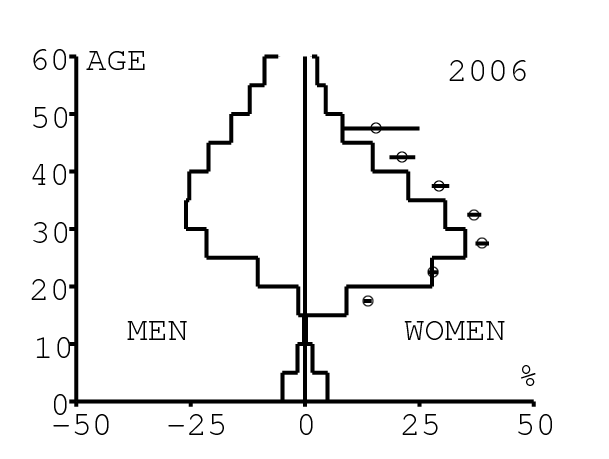
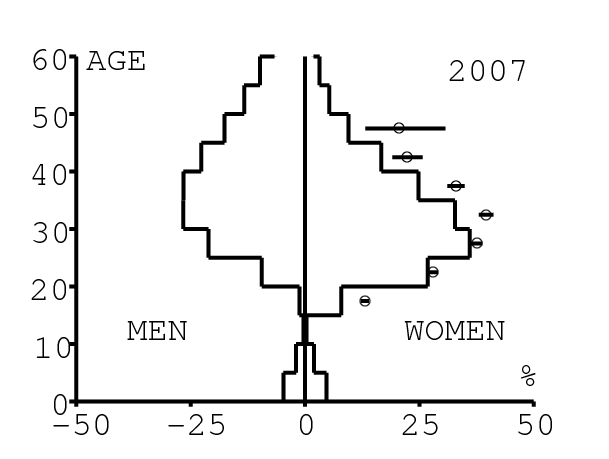
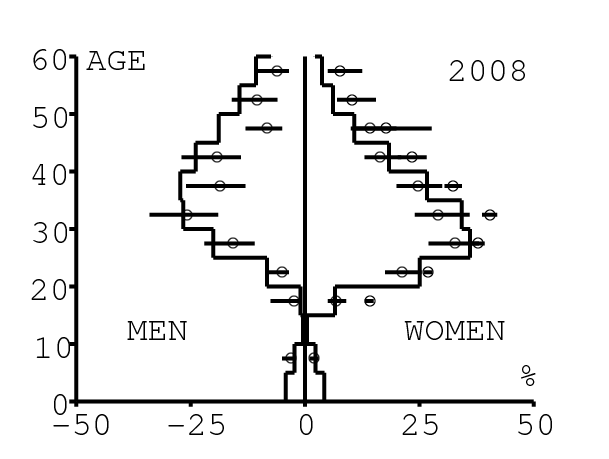
La figure 12 montre comment le modèle s'ajuste aux données par âge concernant la prévalence du VIH par groupes d'âge de 5 années au cours de la période 1991-2008. Rappelons avec la figure 7a que nos trois scénarios ne commencent à différer qu'après 2010. Il y a deux séries de données. La première série représente la prévalence du VIH parmi les femmes dans les cliniques prénatales: elle est donnée sans intervalle de confiance pour les années 1991-1997 dans [8, p. 8] et avec des intervalles de confiance pour les années 1998-2000 dans [5], pour les années 2001-2002 dans [7,p. 9], pour les années 2003-2005 dans [9, p. 13] et pour les années 2006-2008 dans [10, p. 8].
La seconde série de données provient des trois enquêtes nationales faites en 2002 [19], 2005 [20] et 2008 [21]. Elles couvrent non seulement les femmes mais aussi les hommes et les enfants. Les intervalles de confiance sont représentés par des barres horizontales dans la figure 12. Les données sont pour des groupes d'âge de 5 ans sauf pour les enfants en 2002 et 2008 qui sont regroupés dans la classe d'âge de 2 à 14 ans. Les points dans la figure 12 sont mis à l'âge médian des groupes d'âge. Les données des cliniques prénatales surestiment la prévalence chez les femmes du même groupe d'âge, comme on peut le voir pour les années 2002, 2005 et 2008. On a ajusté les paramètres de notre modèle aux données de la population. Les données des cliniques prénatales sont donc des bornes supérieures pour la prévalence simulée. L'ajustement aux données dans la figure 12 n'est pas parfait. La prévalence du VIH est clairement sous-estimée pour les femmes les plus âgées en 2002 et surestimée pour les jeunes femmes en 2005. L'ajustement avec les données de 2008 est assez bon.
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
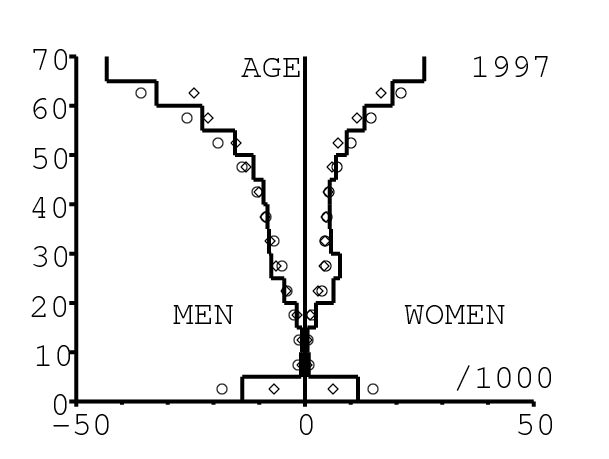
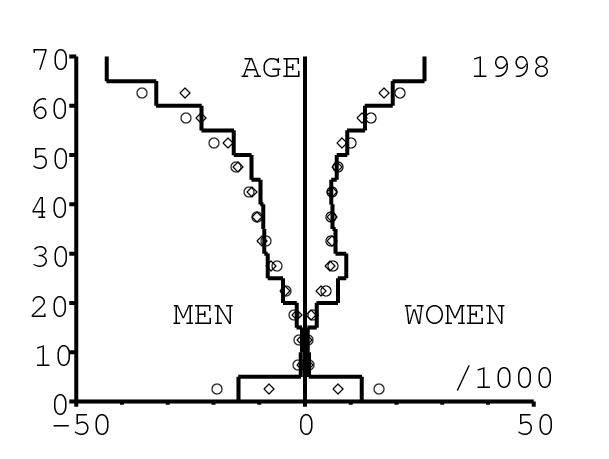
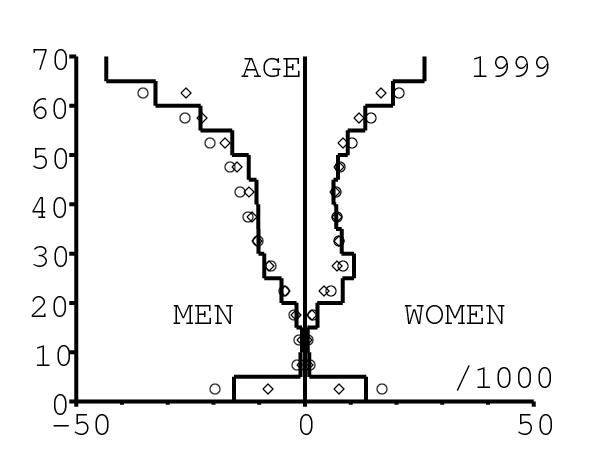
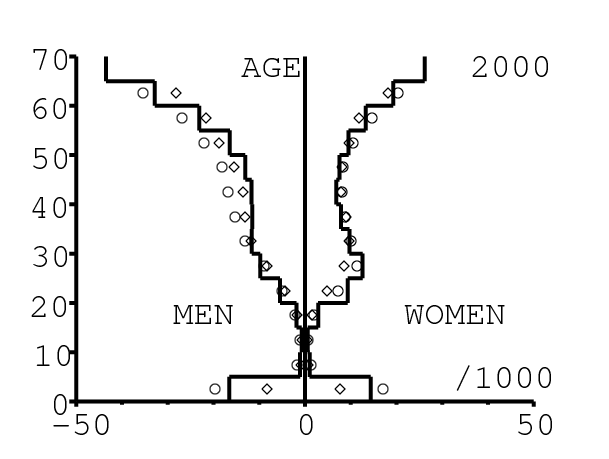
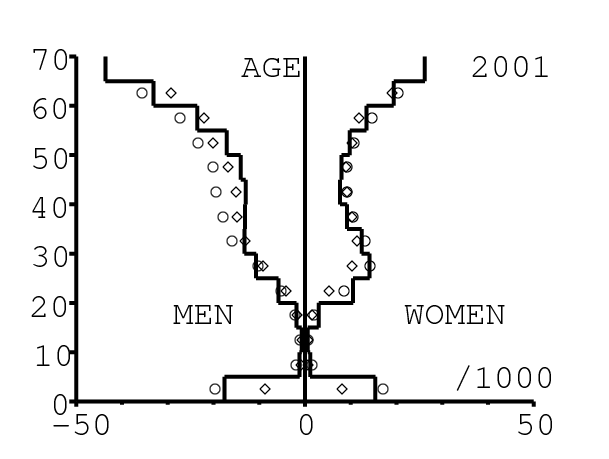
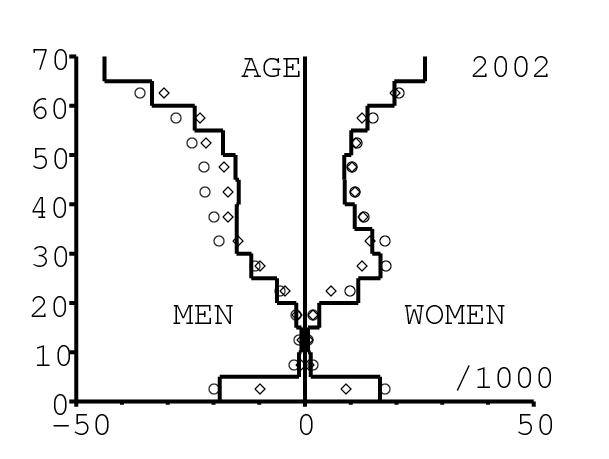
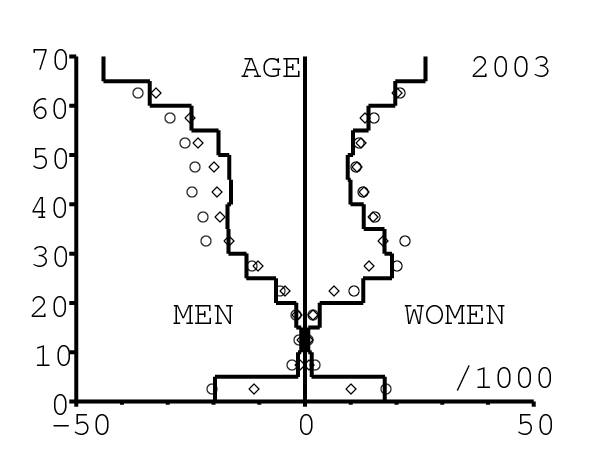
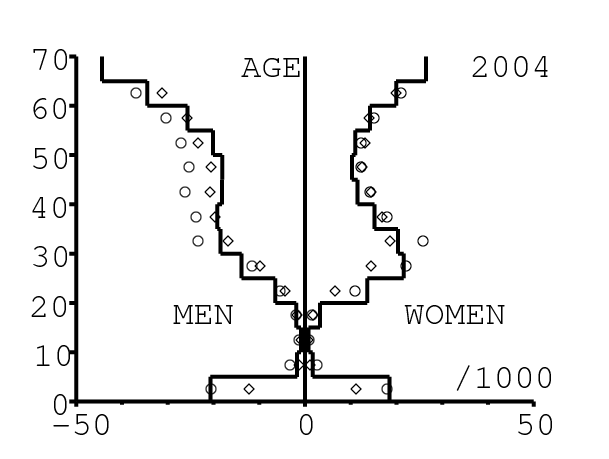
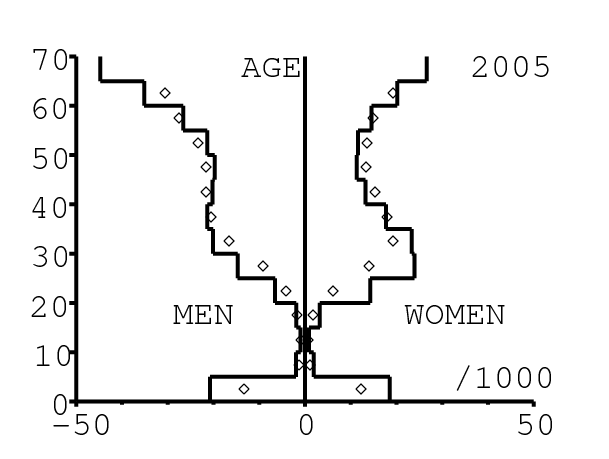
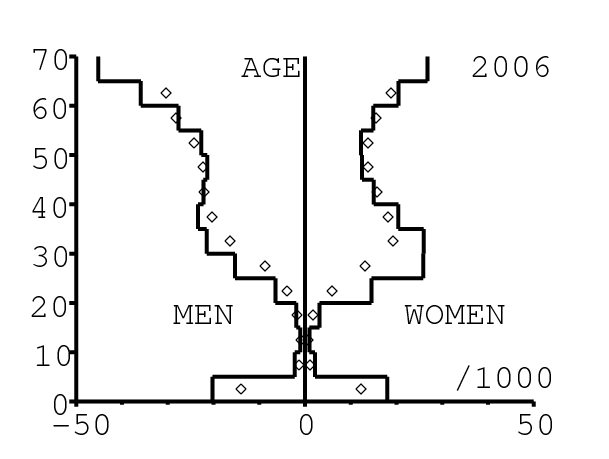
La figure 13 montre comment le modèle s'ajuste aux données par âge concernant la mortalité pour des groupes d'âge de 5 ans. Il y a à nouveau deux séries de données:
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
Étendons la différence entre les courbes de la figure 9a pour l'incidence du VIH à la totalité de la population adulte en Afrique du Sud (environ 35 millions de personnes). La stratégie « tester et traiter » avec 20% de la population testée chaque année permettrait d'éviter 850000 nouvelles infections par rapport au programme actuel d'antirétroviraux sur la période 2010-2020. La stratégie avec 50% de la population testée chaque année permettrait d'éviter 1,4 million de nouvelles infections.
Comparons maintenant les courbes de la figure 8a pour la mortalité. La population totale de l'Afrique du Sud est d'environ 48 millions d'habitants. La stratégie « tester et traiter » avec 20% de la population testée chaque année permettrait d'éviter 1,0 million de décès par rapport au programme actuel d'antirétroviraux sur la période 2010-2020. La stratégie avec 50% de la population testée chaque année permettrait d'éviter 1,5 million de décès
Comparons enfin les courbes de la figure 8b pour la prévalence des antirétroviraux, en remettant cela à l'échelle de la population totale de l'Afrique du Sud. On suppose que les antirétroviraux de première ligne (et éventuellement de seconde ligne) et le suivi médical coûtent environ 1 000 dollars américains par an (voir [14] pour une discussion plus détaillée).
La stratégie « tester et traiter » avec 20% de la population testée chaque année représenterait environ 14 millions de personnes×années d'antirétroviraux de plus que le programme actuel d'antirétroviraux sur la période 2010-2020. Cela coûterait en plus 14 milliards de dollars. Le surcoût par vie sauvé serait d'environ 14 000 dollars. Avec 50% de la population testée, les chiffres seraient 22 millions de personnes×années, 22 milliards de dollars et 15000 dollars.
Ces conclusions ressemblent à celles de [14]. Cependant notre modèle suggère que la fréquence annuelle des tests requise par [14] pour l'élimination à long terme du VIH n'est probablement pas si critique. L'objectif d'une stratégie « tester et traiter » serait plus de détecter un maximum de personnes séropositives parmi les 5 millions qui vivent actuellement en Afrique du Sud et d'éviter leur décès prévisible dans les prochaines années. D'un point de vue plus pratique, une telle stratégie soulève de nombreux problèmes. Mais nos résultats suggèrent qu'il serait intéressant de commencer des essais avec seulement 20% d'une communauté testée chaque année. Tester chaque année un quart de tous les adultes était d'ailleurs déjà un objectif du plan stratégique national pour 2007-2011 en Afrique du Sud (http://www.info.gov.za/otherdocs/2007/aidsplan2007/).
La seconde leçon de notre modèle est que la distribution par âge de l'incidence du VIH a probablement beaucoup varié en Afrique du Sud. Ceci fait douter d'une hypothèse utilisée dans la version actuelle du logiciel EPP/Spectrum utilisé par ONUSIDA pour ses estimations des statistiques du VIH à travers le monde. Plus précisément, Spectrum suppose que la distribution par âge de l'incidence du VIH ne varie pas au cours de l'épidémie. Dans le logiciel Spectrum, la dépendance en temps et en âge de l'incidence n'est pas calculée avec une hypothèse mécaniste, contrairement à notre modèle (voir les équations (1)-(2) de l'appendice). Au lieu de cela, Spectrum utilise l'incidence chez les adultes produite par le logiciel EPP; cette incidence dépend du temps mais pas de l'âge; elle est obtenue par ajustement à des données agrégées de prévalence. Spectrum suppose ensuite que la distribution par âge de l'incidence est telle que dans la figure 9b s'il n'y a pas d'enquête sur la démographie et la santé indiquant la prévalence du VIH dans le pays. S'il y a une ou deux enquêtes, alors la distribution par âge de l'incidence pour une année est calculée à partir de ces enquêtes [15]. Mais la distribution par âge ainsi obtenue est ensuite supposée être restée constante depuis le début de l'épidémie [23, p. 15-17]. Spectrum peut ainsi distribuer l'incidence chez les adultes donnée par EPP entre les différents groupes d'âge. La figure 10 tend à montrer que la distribution par âge de l'incidence peut varier considérablement pendant une épidémie. En résumé, notre modèle suggère de changer la manière avec laquelle Spectrum calcule la distribution par âge de l'incidence en fonction du temps. Une approche mécaniste comme dans notre modèle pourrait être une alternative.
L'indice k désigne soit les femmes (k=f), soit les hommes (k=m).
Le tableau 1 définit les différents paramètres et leurs valeurs. Plus précisément, la surmortalité due au SIDA est \[\rho(x,y)=\rho_0 (1-x/4) + \rho_1(y)\, x/4\] avec \(\rho_0=\mbox{0,4}\) et \[(1-\rho_1(1))(1-\rho_1(2))\cdots (1-\rho_1(y))= \exp(-\mbox{0,0039}\, y^{\mbox{2,25}}).\] Par ailleurs, \[c(t,x)=c_0(t)\, \exp(-c_1(t)\, (x-14)^{\mbox{1,2}}),\quad \forall x\geq 14.\] On suppose que le paramètre \(c_0(t)\,\) croît linéairement de 0 à 10% entre 1987 et 1995, puis de 10% à 80% entre 1995 et 2007, et reste constant par la suite. Le paramètre \(\,c_1(t)\,\) est égal à 0,03 jusqu'en 1998, décroît linéairement jusqu'à 0,01 en 2008, et reste constant par la suite. Il est difficile d'éviter des hypothèses aussi laborieuses vue la forme désirée de la courbe de survie pour les enfants séropositifs (figure 6a) et vues les données concernant l'utilisation des préservatifs (figure 5a,b).
| k | sexe (féminin ou masculin) | \(f\) ou \(m\) | |
| \(t_0\) | année d'introduction du VIH | \(1986\) | [12] |
| t | temps | \(t\geq t_0\) | |
| \(\omega\) | âge maximum considéré | 100 ans | |
| x | âge | \(1\leq x\leq \omega\) | |
| \(y\) | temps depuis l'infection sans antirétroviraux | \(1\leq y \leq x\) | |
| \(x_0\) | âge de la première femme infectée | 16 ans | choix |
| \(b(t_0)\) | naissances annuelles masculines (et féminines) au temps \(t_0\) | 20 | ajustement |
| \(p_f\) | probabilité de transmission du VIH (homme vers femme) | 85% | ajustement |
| \(p_m\) | probabilité de transmission du VIH (femme vers homme) | 50% | ajustement |
| \(q_0\) | probabilité de transmission de la mère à l'enfant | 40% | [23] |
| \(q_1\) | probabilité de transmission de la mère à l'enfant avec prévention | 5% | [23] |
| \(\varepsilon\) | infectiosité relative des personnes sous antirétroviraux | 1% | [14] |
| \(\phi\) | arrêt des antirétroviraux | 1,5% | [14] |
| \(\tau\) | proportion annuelle testée pour le VIH | 0, 20, 50% | |
| \(N_k(t_0,x)\) | pyramide des âges au temps \(t_0\) | figure 1a | [26] | \(\mu_k(x)\) | mortalité si séronégatif | figure 1b | [1] |
| \(b(t)/b(t_0)\) | évolution des naissances | figure 2a | [26] |
| \(\beta(x)\) | fertilité féminine normalisée | figure 2b | [25] |
| \(u\) | sous-déclaration des partenaires sexuels masculins | 0,5 | ajustement |
| \(u\, r(x)\) | taux de rotation des partenaires sexuels masculins | figure 3 | B. Auvert |
| \(s(x,y)\) | choix du partenaire sexuel masculin | figure 4 | données |
| \(c(t,x)\) | utilisation des préservatifs | figure 5 | [6 , 21] |
| \(\rho(x,y)\) | surmortalité due au SIDA | figure 6a | [13] |
| \(\rho_1(y)\) | surmortalité due au SIDA chez les adultes | figure 6a | [14] |
| \(\sigma(y)\) | mortalité sous antirétroviraux | \(\rho_1(y)/2\) | |
| \(h_1(t)\) | accès à la prévention de la transmission de la mère à l'enfant | figure 6b | [27] |
| \(h_2(t)\) | accès au programme actuel d'antirétroviraux | figure 7a | |
| \(h_3(t)\) | accès à « tester et traiter » | figure 7a | |
| \(\psi\) | proportion démarrant les antirétroviraux actuellement | 40% | ajustement |
Gardons les notations de [14] et posons \(J_k(t,x)=I^*_k(t,x)+\varepsilon\, A^*_k(t,x)\). On suppose que la force d'infection est \begin{align*} \lambda_f(t,x)&=1-\exp \Bigl (-p_f \, (1-c(t,x))\, r(x) \sum_z s(x,z)\, J_m(t,z)/N_m(t,z)\Bigr )\; ,\\ \lambda_m(t,x)&=1-\exp\Bigl (-p_m \sum_z (1-c(t,z))\, r(z)\, s(z,x)\, J_f(t,z)/ N_m(t,x)\Bigr )\; . \end{align*} \(\lambda_f(t,x)\) et \(\lambda_m(t,x)\) sont tous les deux compris entre 0 et 1. Lorsque la prévalence du VIH et des antirétroviraux est petite, on a \begin{align} \lambda_f(t,x)&\simeq -p_f \, (1-c(t,x))\, r(x) \sum_z s(x,z)\, J_m(t,z)/N_m(t,z)\; ,\tag{1}\\ \lambda_m(t,x)&\simeq -p_m \sum_z (1-c(t,z))\, r(z)\, s(z,x)\, J_f(t,z)/ N_m(t,x)\; .\tag{2} \end{align} En ce qui concerne \(\,\lambda_f(t,x)\,\),
La probabilité pour qu'un nouveau-né soit séropositif est \[\pi(t)=\Bigl (q_0 (1-h_1(t))+q_1 h_1(t)\Bigr ) \, \frac{\sum_x \beta(x)\, I^*_f(t,x)}{\sum_x \beta(x) N_f(t,x)}\; ,\] ce qui suppose que les femmes sous antirétroviraux depuis quelques années ne transmettent pas le VIH à leurs enfants.
On suppose que le taux de démarrage des antirétroviraux est \[\theta(t,x,y)= h_2(t)\; \rho(x,y)\, \psi/(1-\psi) + h_3(t)\; \tau.\] Noter qu'avec le programme d'antirétroviraux actuel (\(h_2=1\) et \(h_3=0\)), les personnes séropositives sont sujettes à deux risques en parallèle: le risque de mourir au taux \(\rho(x,y)\) et le risque (ou plutôt la chance) de démarrer les antirétroviraux au taux \(\rho(x,y)\, \psi/(1-\psi)\). Ainsi une fraction ψ finit par démarrer les antirétroviraux.
Définissons la condition initiale au temps \(\,t_0\). \(N_k(t_0,x)\,\) est donné pour tout 1≤x≤ω.
Avec \(t\geq t_0\) et \(1\leq x\leq \omega-1\,\), la population saine est donnée par \begin{align*} S_k(t+1,1)&=b(t)\, (1-\pi(t)),\\ S_k(t+1,x+1)&=(1-\mu_{k}(x)) (1-\lambda_k(t,x)) S_k(t,x)\; . \end{align*} La population infectée sans traitement est donnée pour \(t\geq t_0\) et \(1\leq y\leq x\leq \omega-1\) par \begin{align*} I_k(t+1,1,1)&=b(t)\, \pi(t),\\ I_k(t+1,x+1,1)&=(1-\mu_{k}(x))\, \lambda_k(t,x)\, S_k(t,x),\\ I_k(t+1,x+1,y+1)&=(1-\mu_{k}(x)) (1-\rho(x,y)) (1-\theta(t,x,y))\, I_k(t,x,y)\\ &\quad +\phi\, (1-\mu_{k}(x)) (1-\sigma(y))\, A_k(t,x,y)\; . \end{align*} La population sous traitement est donnée pour \(t\geq t_0\) et \(1\leq y\leq x\leq \omega-1\) par \begin{align*} A_k(t+1,x+1,y)&=(1-\phi) (1-\mu_{k}(x)) (1-\sigma(y))\, A_k(t,x,y) \\ &\quad + (1-\mu_{k}(x)) (1-\rho(x,y))\, \theta(t,x,y) \, I_k(t,x,y) \; , \end{align*} et \(A_k(t,1,1)=0\,\) pour tout t.
On a présenté des parties de cet article à la réunion de travail de l'OMS Modelling the Impact of ART on TB and HIV (Genève, 4-6 novembre 2009) et à la réunion d'ONUSIDA « Developing Models for HIV Estimates » (Londres, 19-20 janvier 2010, http://www.epidem.org). On remercie en particulier Brian Williams pour ses suggestions et Mercy Kamupira pour avoir partagé des données.