Comptes Rendus. Chimie, 2020, 23, no. 1, p. 47-55
Akram Ashouri ; Saadi Samadi ; Masoud Ahmadian ; Behzad Nasiri
Les amines jouent un rôle important dans les activités biologiques [ 1 , 2 ], pharmacologiques [ 3 ] et agricoles [ 4 ]. Ainsi, la synthèse d'amines substituées (motif structurel actif de plusieurs médicaments tels que la cétirizine [ 5 ], la sertraline [ 6 ], la rasagiline [ 7 ] et la rivastigmine [ 8 ]) suscite une attention croissante.

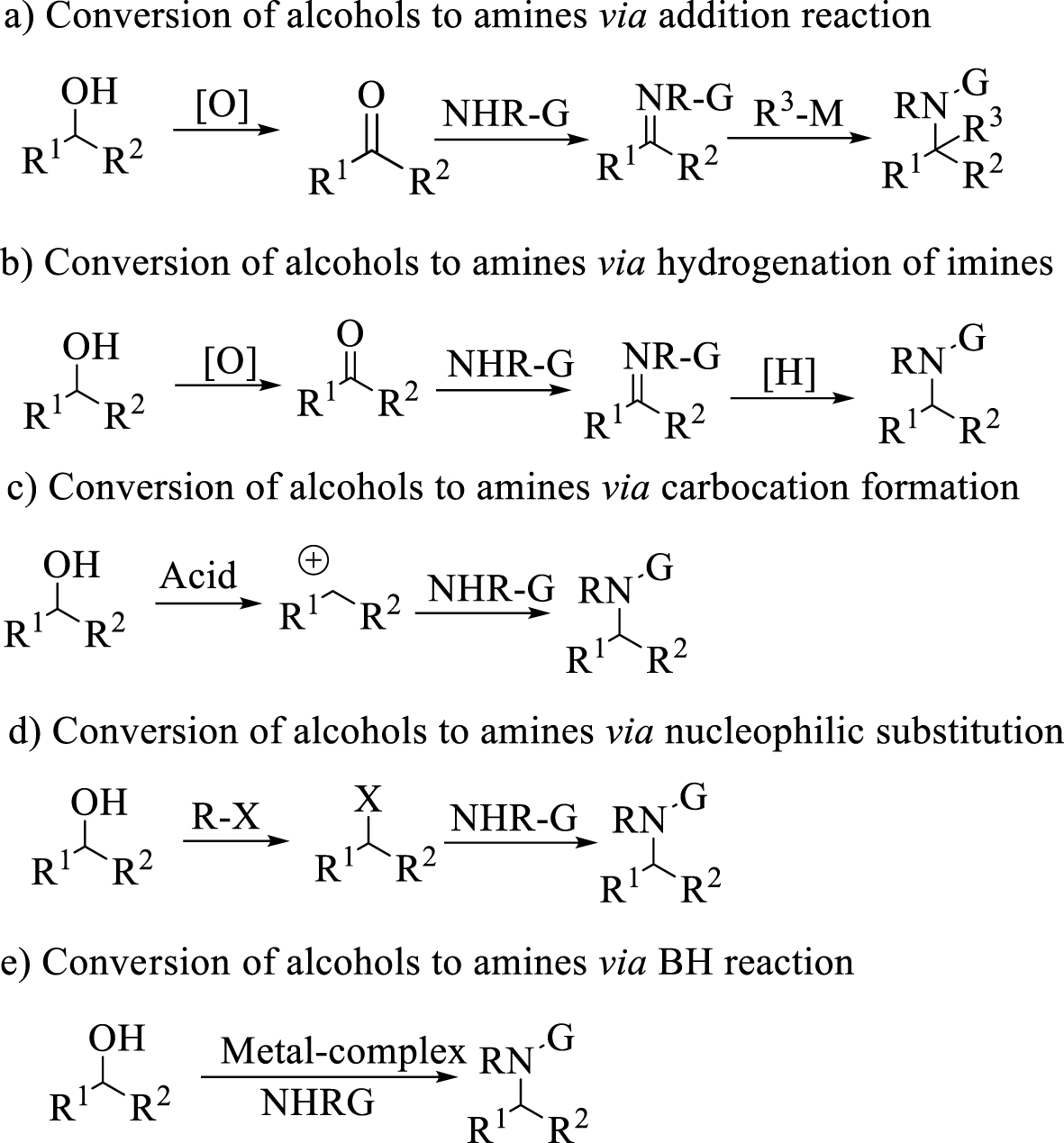
Les alcools sont généralement des substrats peu coûteux et des sources disponibles pour préparer des amines. Ils sont généralement convertis en aldéhydes [ 9 ], cétones [ 10 ], imines [ 11 ] ou autres composés apparentés avant de réagir avec les nucléophiles. Parallèlement à toutes les avancées dans l'addition de catalyseurs au rhodium des réactifs organométalliques aux imines produisant de la diarylamine [ 12 ], de nombreuses méthodes ont été rapportées dans la littérature, basées sur l'hydrogénation des imines et des énamines [ 13 , 14 ], l'amination des cétones et l'amination des halogénures d'alkyle [ 15] ] (Schéma 1). Parmi eux, les réactions d'hydrogénation sont beaucoup plus importantes dans la recherche ou l'industrie, et l'utilisation de l'hydrogène gazeux ou la réduction de l'hydrogénation par transfert avec des catalyseurs de Brønsted [ 16 ] ou de Lewis [ 17 , 18 , 19 ] et des complexes de métaux de transition d'Ir, Pd, Rh est bien établi [ 20 , 21 , 22 ]. Malgré de nombreux rapports sur ces réactions, ces voies en plusieurs étapes souffrent souvent de l'instabilité des intermédiaires, de la faible économie d'atomes et de la production de sous-produits. En outre, les inconvénients des catalyseurs à base d'Ir, de Pd et de Rh tels que la toxicité, le coût élevé et les problèmes de lixiviation des métaux [ 23] ont limité leur large utilisation pour ces réactions. Utiliser des protocoles qui offrent des avantages par rapport à ces limitations à l'échelle industrielle va être un défi.
Ces dernières années, un protocole vert, économique et respectueux de l'environnement a été conçu pour produire des amines substituées par une réaction d'emprunt d'hydrogène (méthodologie BH) [ 24] sans avoir besoin de sources d'hydrogène supplémentaires. Le point principal de cette réaction peut être le stockage temporaire de l'hydrogène, qui est libéré du substrat nucléophile vers le catalyseur métallique électrophile pendant le processus d'oxydation douce. Après la conversion de l'intermédiaire oxydé en intermédiaire à double liaison C = X, le catalyseur à hydrure métallique a renvoyé l'hydrogène à la double liaison C = X qui est plus électrophile que le substrat initial. Par conséquent, le développement d'une méthodologie efficace de BH catalytique a attiré plus d'attention ces dernières années. En outre, en raison de la stabilité du métal-hydrid formé avec les catalyseurs de métaux de transition des deuxième et troisième rangées, qui empêche le retour de l'hydrogène activé [ 25], ces métaux ne sont pas adaptés à la méthodologie BH. Par conséquent, le développement de l'utilisation de métaux actifs dans ces réactions a été beaucoup mis en évidence. En 2013, Singh et ses collègues ont signalé la conversion d'alcools benzyliques primaires en N -alkylamines en utilisant la phtalocyanine Fe (II) comme catalyseur [ 26 ]. En 2014, Feringa et Barta ont rapporté du fer carbonyle (cyclopentadiénone) comme précatalyseur pour le couplage direct d'alcools et d'amines par le biais de la méthodologie BH [ 27 ]. En 2014, Zhao et ses collègues ont rapporté une méthode catalytique pour l'amination d'alcools en présence d'un complexe d'iridium et d'acide phosphorique. En 2018, Sunoj et ses collègues ont signalé l'amination d'alcools en présence de complexe iridium-diamine et d'acide phosphorique [ 28]. En 2019, Barta et ses collègues ont signalé une amination directe d'alcools benzyliques à l'aide de NH3 en présence de catalyseur Ni (OTf)2∕ dcpp [ 29 ]. En 2019, Hofmann et Hultzsch ont également rapporté la N-alkylation d'anilines avec des alcools benzyliques en utilisant le complexe de Knölker ligaturé au nitrile [ 30 ].
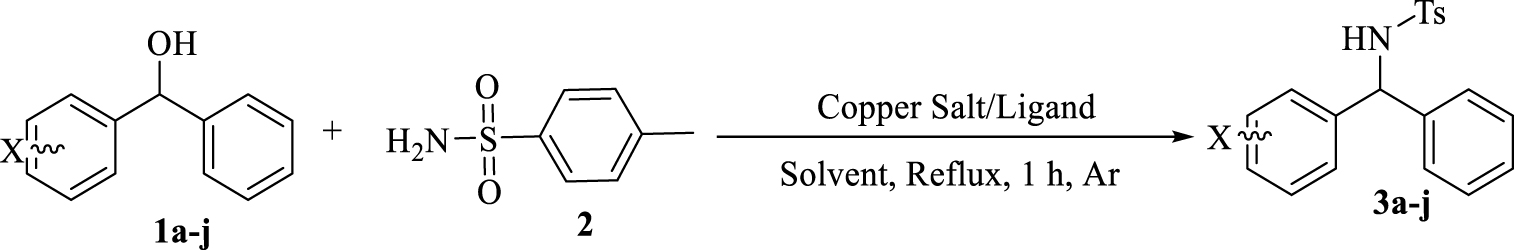
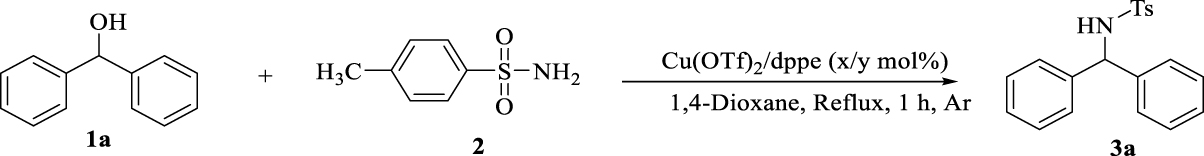
Dans ce contexte, pour la préparation de diarylamines dans une méthodologie BH propre, adaptée et attrayante, nous rapportons une réaction en une étape au sein de dérivés de benzhydrol et de p- toluène sulfonamide en présence de complexes cuivre-bisphosphine. Cette méthodologie bénéficie de l'utilisation de sels de cuivre facilement disponibles et à faible coût, ne nécessite aucun acide, base ou réactif d'activation supplémentaire pour activer l'alcool, aucune source d'hydrogène et entraîne la formation de H2O comme seul sous-produit après 1 h (Schéma 2 ).
N - [(phényl) phénylméthyl] -4- méthylbenzènesulfonamide (3a)
Solide blanc; rendement: 346 mg (98%); PF 148–151 ° C [ 32 ]: RMN 1 H (500 MHz, CDCl3): δ 7,59 (d, J = 8,0 Hz, 2 H), 7,20–7,25 (m, 6 H), 7,10-7,17 (m , 6 H), 5,57 (d, J = 7,2 Hz, 1 H), 5,34 (d, J = 7,1 Hz, 1 H), 2,38 (s, 3 H); 13 C RMN (100 MHz, CDCl3): 142,1, 139,5, 128,3, 127,5 (4 C), 127,3, 126,5 (2 C), 126,2 (4 C), 126,1 (2 C), 60,3, 20,4.
N - ((4-chlorophényl) (phényl) méthyl) -4-méthylbenzènesulfonamide (3b)
Solide blanc; rendement: 367 mg (95%) pf 115-116 ° C [ 33 ]. RMN 1 H (500 MHz, CDCl3): δ 7,56 (d, J = 8,1 Hz, 2 H), 7,23–7,245 (m, 3 H), 7,16–7,23 (m, 4 H), 7,04–7,11 (m , 4 H), 5,54 (d, J = 6,9 Hz, 1 H), 5,10 (d, J = 6,9 Hz, 1 H), 2,42 (s, 3 H). 13 C RMN (100 MHz, CDCl3) 141,2, 139,8, 139,6, 137,2, 133,1, 128,4, 127,6 (2 C), 127,6, 126,8, 126,1 (2 C), 59,6, 20,3.
N - ((3-chlorophényl) (phényl) méthyl) -4-méthylbenzènesulfonamide (3c)
Solide blanc; rendement: 348 mg (90%); PF 126 à 128 ° C [ 34 ].
N - ((2-chlorophényl) (phényl) méthyl) -4-méthylbenzènesulfonamide (3d)
Solide blanc; rendement: 367 mg (95%) pf 171-172 ° C [ 33 ]. RMN 1 H (500 MHz, CDCI3): δ 7,62 (d, J = 8,2 Hz, 2H), 7,32 - 7,37 (m, 1H), 7,20 - 7,25 (m, 4H), 7,13 - 7,18 (m, 4H) , 7,07 (dd, J = 7,0, 2,2 Hz, 2 H), 5,92 (d, J = 7,2 Hz, 1 H), 5,31 (d, J = 7,2 Hz, 1 H), 2,38 (s, 3 H).
N - ((4-bromophényl) (phényl) méthyl) -4-méthylbenzènesulfonamide (3e)
Solide blanc; rendement: 389 mg (90%); PF 117 à 119 ° C [ 35 ]. RMN 1 H (500 MHz, CDCI3): δ 7,54 (d, J = 8,2 Hz, 2H), 7,32 (d, J = 8,5 Hz, 2H), 7,20 - 7,23 (m, 3H), 7,14 (d, J = 8,0 Hz, 2H), 7,05 (dd, J = 6,5, 2,9 Hz, 2H), 7,00 (d, J = 8,4 Hz, 2H), 5,52 (d, J = 7,1 Hz, 1H), 5,21 (d, J = 7,1 Hz, 1 H), 2,39 (s, 3 H).
N - ((4-fluorophényl) (phényl) méthyl) -4-méthylbenzènesulfonamide (3f)
Solide blanc; rendement: 353 mg (95%); PF 123-124 ° C [ 36 ]. RMN 1 H (500 MHz, CDCI3): δ 7,55 (d, J = 8,3 Hz, 2H), 7,17 - 7,21 (m, 3H), 7,02 - 7,07 (m, 4H), 6,92 - 6,96 (m, 4H) , 5,54 (d, J = 7,1 Hz, 1 H), 5,16 (d, J = 7,0 Hz, 1 H), 2,39 (s, 3 H).
N - ((4-méthoxyphényl) (phényl) méthyl) -4-méthylbenzènesulfonamide (3g)
Solide blanc; rendement: 326 mg (85%); PF 126 à 128 ° C [ 37 ].
4-méthyl-N - ((4-nitrophényl) (phényl) méthyl) benzènesulfonamide (3h)
Solide jaune clair; rendement: 367 mg (92%); pf 125 à 126 ° C [ 38 ]. RMN 1 H (500 MHz, CDCI3): δ 7,58 (d, J = 8,1 Hz, 2H-Ar), 7,22–7,26 (m, 3H, Ar-H), 7,22–7,16 (m, 4H), 7,10– 7,04 (m, 4H) 5,55 (d, J = 6,9 Hz, 1 H, NCH), 5,01 (d, J = 6,9 Hz, 1 H, HN), 2,42 (s, 3 H).
4-méthyl-N- (phényl (p-tolyl) méthyl) benzènesulfonamide (3i)
Solide blanc; rendement: 312 mg (85%); PF 128 à 130 ° C [ 33 ]. RMN 1 H (500 MHz, CDCI3): δ 7,54 - 7,59 (m, 2H), 7,17 - 7,23 (m, 3H), 7,14 (d, J = 8,0 Hz, 2H), 7,08 - 7,12 (m, 2H) , 6,99 (d, J = 8,1, 8,1 Hz, 4H), 5,52 (d, J = 7,0 Hz, 1H), 5,06 (d, J = 6,9 Hz, 1H), 2,38 (s, 3H), 2,28 (s, 3H).
4-méthyl-N- (phényl (4- (trifluorométhyl) phényl) méthyl) benzènesulfonamide (3j)
Solide blanc; rendement: 379 mg (90%); PF 122-124 ° C [ 39 ]. RMN 1 H (500 MHz, CDCI3): δ 2,35 (s, 3H), 5,34 (d, J = 7,2 Hz, 1H), 5,59 (d, J = 7,2 Hz, 1H), 7,01 - 7,05 (m, 2H) ), 7,10 (d, J = 8,0 Hz, 2H), 7,23 (s, 1H), 7,19 - 7,23 (m, 3H), 7,25 (s, 1H), 7,42 (d, J = 8,2 Hz, 2H), 7,51 (d, J = 8,3 Hz, 2H).
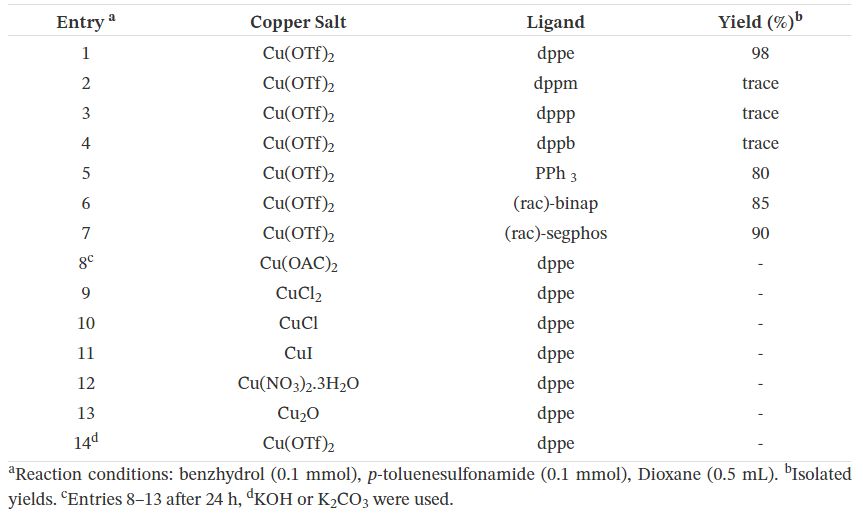
Initialement, la réaction modèle a été réalisée en utilisant du benzhydrol ( 1a ) (0,1 mmol), du p- toluène sulfonamide ( 2 ) (0,1 mmol) au reflux du 1,4-dioxane sous atmosphère d'argon avec formation de traces du produit souhaité ( 3a). après 10 h. Lorsque la réaction a été effectuée en présence de Cu (OTf)2, la vitesse de réaction a augmenté et des rendements de 30% ont été obtenus après 10 h.
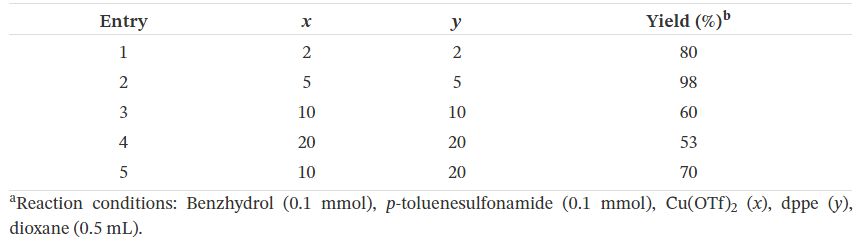
Dans l'essai suivant, la réaction a été effectuée en présence de Cu (OTf)2(5 mol%), dppe (5 mol%) qui a permis à la vitesse et au rendement de la réaction de s'améliorer significativement (98%) après 1 h. Nous avons optimisé les conditions, criblé de nombreux ligands et sels de cuivre, solvants, le rapport des substrats, la quantité de sels de cuivre et de ligands et également en utilisant une base pour diminuer significativement le temps de réaction. Comme le montrent les résultats (tableau 1 ), les réactions réalisées en utilisant dppm, dppp et dppb ne montrent pas de conversion significative, alors qu'en présence de PPh3, le produit souhaité a été obtenu avec un rendement de 80%. En utilisant (rac) -binap et (rac) -segphos, les produits ont été préparés avec des rendements de 85 et 90% respectivement (tableau 1, entrées 2–7). De manière surprenante, d'autres sels de cuivre n'ont pas pu favoriser la réaction (entrées 8–13). La réaction ne s'est pas non plus déroulée en présence de bases, même de bases non coordinantes (tableau 1 , entrée 14). Dans des conditions basiques, le catalyseur hydrure de métal / H (OTf) formé devient inactif et la réaction ne se déroule pas.
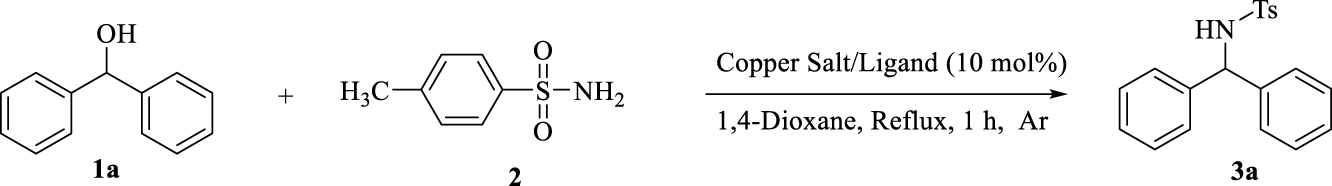
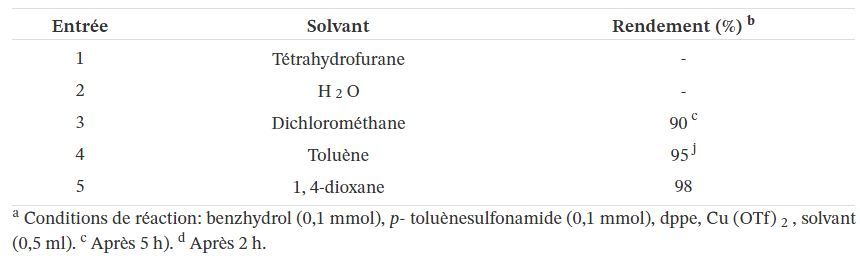
Ensuite, nous avons étudié l'effet du solvant. En général, la réaction BH dans les solvants organiques courants progresse avec une faible conversion vers le produit souhaité. Cela peut être dû à une réduction insuffisante de l'imine. Le degré de stabilité de l'intermédiaire métal-hydrure est crucial, qui est directement affecté par le solvant. Si l'intermédiaire métal-hydrure est trop stable, il ne peut pas retourner facilement l'hydrure. S'il n'est pas suffisamment stable, il ne peut pas entrer dans le cycle catalytique. Par conséquent, il apparaît qu'un solvant faiblement coordonné peut stabiliser l'intermédiaire d'hydrure métallique pour améliorer l'étape de réduction d'imine. Comme indiqué dans le tableau 2, aucun produit souhaité n'a été observé dans le tétrahydrofurane et l'eau, tandis que la réaction s'est déroulée avec des rendements élevés en dichlorométhane ou en toluène (90% et 95%, respectivement), mais pas aussi rapidement que dans le 1,4-dioxane qui a fourni le produit souhaité dans les deux excellent rendement et taux.
L'influence du rapport du substrat a été évaluée sur le rendement et la vitesse de réaction. L'augmentation de la quantité de benzhydrol n'a pas d'effet notable sur le rendement, mais la réactivité et la vitesse de réaction ont diminué et de l'alcool n'ayant pas réagi a été observé (tableau 3 ). Ensuite, nous avons étudié l'effet des quantités de chargement du système catalytique avec le meilleur résultat obtenu en utilisant Cu (OTf)2et dppe (1: 1, 5 mol% de benzhydrol) (tableau 4 , entrée 2). Par la suite, aucune réaction ne s'est produite à température ambiante.
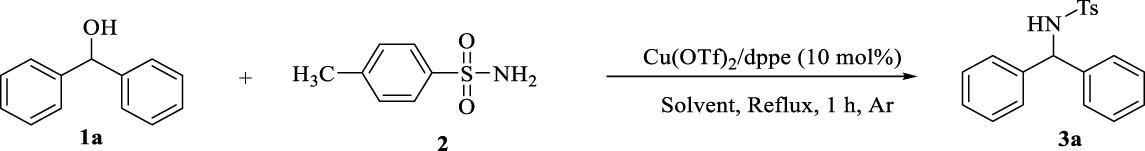
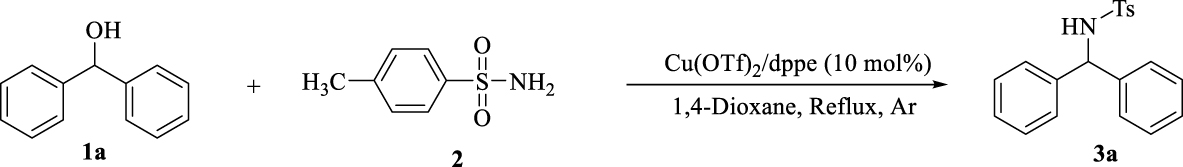

Nous avons étendu les conditions optimales à différents dérivés du benzhydrol. Les résultats sont présentés dans le tableau 5 et différentes diarylamines substituées ont été obtenues avec des rendements élevés à excellents (90 à 98%) dans les conditions de réaction optimales.
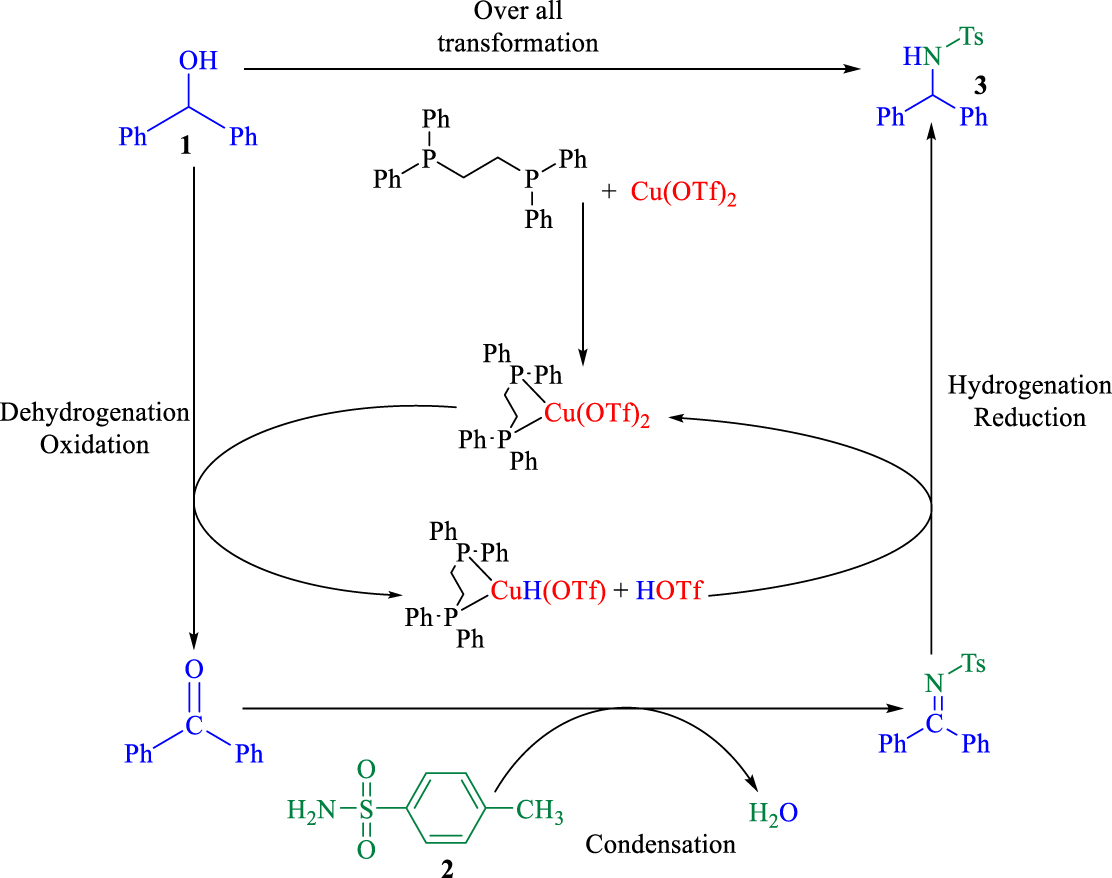
Dans des conditions optimisées, un mécanisme BH est suggéré dans le schéma 3 . En présence de catalyseur dppe-Cu (OTf)2, le benzhydrol est converti pendant l'étape d'oxydation en benzophénone qui est plus réactive dans la réaction nucléophile, ce qui entraîne la génération du catalyseur dppe-Cu (OTf) -H / H (OTf) . Ensuite, la benzophénone a immédiatement réagi avec l'amide et un intermédiaire imine a été produit. Table 5. Portée de la réaction a un rendement isolé. Dans l'étape de réduction, l'hydrure a été renvoyé du catalyseur dppe-Cu (OTf) -H / H (OTf) à l'imine de sorte que le produit souhaité et le catalyseur Cu (OTf)2ont été obtenus. En raison de la formation rapide de l'intermédiaire imine dans le cycle catalytique, les réactions secondaires ont été complètement supprimées et l'eau est le seul sous-produit [ 40 ]. Par conséquent, cette méthodologie est une méthode hautement efficace et économique en atomes produisant des amines de grande valeur pour la chimie pharmaceutique et synthétique.